Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Hidrolisis Garam
MATERI
pH Larutan Garam

pH larutan garam dari asam dan basa kuat yang tepat habis bereaksi adalah pH = 7.
pH larutan garam dari asam dan basa bukan kuat dihitung dengan tetapan hidrolisis (Kh), dan tetapan ionisasi asam dan basa (Ka dan Kb).
Garam dari asam kuat dan basa lemah bersifat asam atau pH < 7.
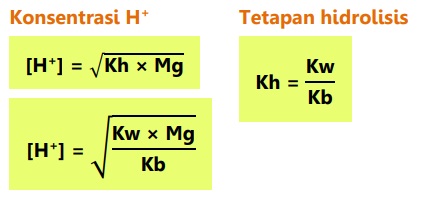
Jika garam berasal dari kation atau anion yang salah satunya bervalensi dua, maka:
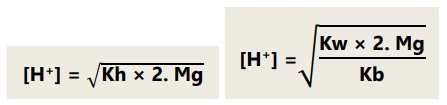
Garam dari basa kuat dan asam lemah bersifat basa atau pH > 7.
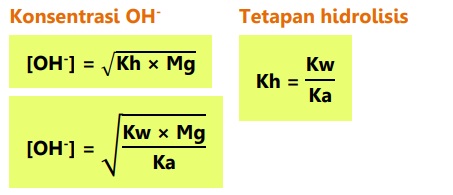
Jika garam berasal dari kation atau anion yang salah satunya bervalensi dua, maka:
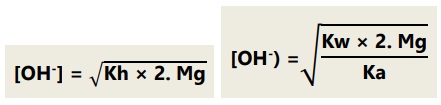
Garam dari asam lemah dan basa lemah:
- Jika Ka = Kb
Maka garam bersifat netral atau pH = 7. - Jika Ka > Kb
Maka garam bersifat asam atau pH < 7.
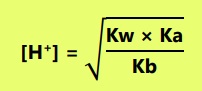
- Jika Kb > Ka
Maka garam bersifat basa atau pH > 7.

Derajat hidrolisis adalah derajat yang menunjukkan tingkat kesempurnaan hidrolisis.
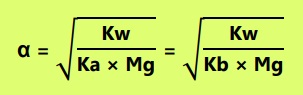
Keterangan :
[H+] : konsentrasi ion H+
[OH-] : konsentrasi ion OH-
Kw : tetapan kesetimbangan air
Ka : tetapan ionisasi asam lemah
Kb : tetapan ionisasi basa lemah
Kh : tetapan hidrolisis
Mg : komponen garam yang mengalami hidrolisis
alfa : derajat ionisasi
1.
Kerjakan soal berikut!
Dari garam berikut yang mengalami hidrolisis total adalah....
A. NH4Br
B. K2CO3
C. BaCO3
D. AlCl3
E. Al2(CO3)3
JAWABAN BENAR
E.
Al2(CO3)3
PEMBAHASAN
Karena garam Al2(CO3)3 terbentuk dari asam lemah dan basa lemah.
2.
Kerjakan soal berikut!
Dari beberapa larutan berikut ini yang mengalami hidrolisis parsial adalah...
A. K2SO4
B. CH3COONa
C. NH4CN
D. MgSO4
E. NaCl
JAWABAN BENAR
B.
CH3COONa
PEMBAHASAN
Hidrolisis parsial terjadi pada garam yang terbentuk dari asam kuat dan basa lemah atau terbentuk dari basa kuat dan asam lemah. CH3COONa terbentuk dari asam lemah dan basa kuat jadi terhidrolisis parsial.
3.
Kerjakan soal berikut!
Jika dua larutan masing-masing mengandung 25 mL NaOH 0,2 M dan 25 mL CH3COOH 0,2 M dengan Ka CH3COOH = 10-5 dicampurkan, maka pH nya adalah...
A. 3
B. 4
C. 5
D. 9
E. 10
JAWABAN BENAR
D.
9
PEMBAHASAN
Pembahasan
Data:
mol NaOH = 25 mL x 0,2 M = 5 mmol
mol CH3COOH = 25 mL x 0,2 M = 5 mmol
Reaksi yang terjadi dan mol yang terbentuk adalah sebagai berikut:

Tentukan konsentrasi anion yang terhidrolisis terlebih dahulu melalui konsentrasi CH3COONa yang terbentuk:
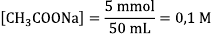
[CH3COO-]
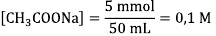
[OH-] dan pH dengan demikian adalah
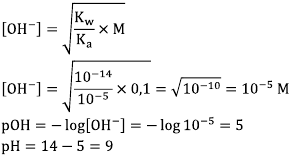
4.
Kerjakan soal berikut!
Sebanyak 50 mL larutan HNO2 0,1 M direaksikan dengan 50 mL KOH yang molaritasnya 0,1 M.
Reaksi yang terjadi:
KOH(aq) + HNO2(aq) --> KNO2(aq) + H2O(l)
Jika Kw air = 10-14 dan Ka HNO2 = 5 x 10-4 maka besar pH campuran tersebut adalah....
A. 1
B. 5
C. 6
D. 7
E. 8
JAWABAN BENAR
E.
8
PEMBAHASAN
Karena semua koefisien dalam reaksi sama, maka
mol KNO2 = 50 mL x 0,1 M = 5 mmol
molaritas KNO2
[g] = 5 mmol/(50 mL + 50 mL)
[g] = 5 x 10-2 M
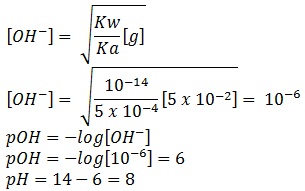
5.
Kerjakan soal berikut!
Larutan 25 mL HCl 0,2 M direaksikan dengan 25 mL NH3 0,2 M sesuai reaksi:
NH3(aq) + HCl(aq) --> NH4Cl(aq)
Harga pH larutan yang terjadi adalah …. (Kb NH3 = 10-5)
A. 5
B. 7
C. 9
D. 13 - log 2
E. 13 + log 2
JAWABAN BENAR
A.
5
PEMBAHASAN
Karena koefisiennya sama, maka
mol NH4Cl = mol HCl
mol NH4Cl = 25 mL x 0,2 M
mol NH4Cl = 5 mmol
molaritas NH4Cl:
[g] = 5 mmol/(25 mL + 25 mL)
[g] = 0,1 M
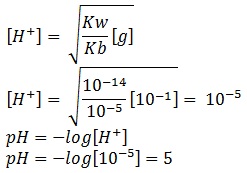
6.
Perhatikan soal berikut!
pH dari larutan yang terbentuk pada hidrolisis garam NaCN 0,01 M, jika diketahui Ka HCN = 1 x 10-10 adalah ...
A. 9
B. 10
C. 11
D. 12
E. 13
JAWABAN BENAR
C.
11
PEMBAHASAN
NaCN --> Na+ + CN-
0,01M
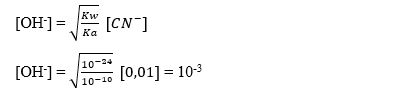
pOH = - log [OH-]
pOH = - log 10-3 = 3
pH = 14 – 3 = 11
7.
Kerjakan dengan teliti!
Larutan KCN dalam air akan bersifat basa, reaksi yang menunjukkan terjadinya sifat basa tersebut adalah…
A. K+ + OH– --> KOH
B. CN– + H+ --> HCN
C. K+ + H2O --> KOH + H+
D. CN– + KOH --> KCN + OH–
E. CN– + H2O --> HCN + OH–
JAWABAN BENAR
E.
CN– + H2O --> HCN + OH–
PEMBAHASAN
Karena Hidrolisis yang berasal dari asam lemah menghasilkan ion OH– . akibatnya kosentrasi ion OH– menjadi lebih tinggi dibandingkan konsentrasi ion H+. Dengan demikian, larutan garam tersebut bersifat basa dan memiliki pH > 7.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


