Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Kelarutan dan Hasil Kali Kelarutan
MATERI
Pengaruh Ion Senama

Kelarutan zat dipengaruhi oleh ion penyusun pelarut.
Kelarutan zat pada pelarut yang mengandung ion senama dengan zat akan memperkecil kelarutan karena menggeser kesetimbangan.
Contoh:
Kelarutan AgCl pada NaCl dipengaruhi ion Cl-,
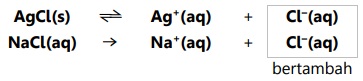
Kesetimbangan bergeser ke kiri karena Cl- bertambah, sehingga lebih banyak AgCl yang mengendap dalam NaCl dibanding dalam air.
Nilai kelarutan ion senama dari zat yang dilarutkan diabaikan karena nilainya kecil, dan yang digunakan adalah konsentrasi ion senama dari pelarut.
Contoh:
Jika Ksp PbCl2 = 1,7 x 10-5 , berapa kelarutan PbCl2 dalam HCl 0,1 M?

Pengaruh pH Larutan

Kelarutan zat juga dipengaruhi oleh pH larutan, yaitu dipengaruhi oleh ion OH-.
Zat-zat yang kelarutannya dipengaruhi oleh pH:
- Basa mudah larut dalam larutan netral dan asam.
- Garam dari asam lemah mudah larut dalam asam kuat.
- Garam dari basa lemah mudah larut dalam basa kuat.
Kelarutan basa pada pelarut basa akan memperkecil kelarutan karena menggeser kesetimbangan.
Contoh:
Kelarutan Fe(OH)2 pada NaOH,
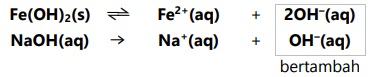
Kesetimbangan bergeser ke kiri karena OH- bertambah, sehingga lebih banyak Fe(OH)2 yang mengendap dalam NaOH dibanding dalam air.
Kelarutan garam pada pelarut basa akan memperkecil kelarutan karena reaksi hidrolisis garam menggeser kesetimbangan.
Contoh:
Kelarutan BaCO3 pada NaOH,
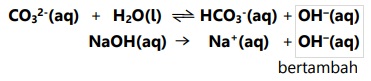
Kesetimbangan bergeser ke kiri karena OH- bertambah, sehingga lebih banyak BaCO3 yang mengendap dalam NaOH dibanding dalam air.
Nilai kelarutan OH- dari zat yang dilarutkan diabaikan karena nilainya kecil, dan yang digunakan adalah konsentrasi OH- dari pelarut.
Contoh:
Larutan jenuh Mg(OH)2 memiliki pH 10. Tentukan kelarutannya dalam larutan dengan pH 12.

Meramalkan Pengendapan

Pengendapan terjadi pada suatu larutan yang telah jenuh.
Larutan yang telah jenuh oleh suatu zat masih mengalami pelarutan walau sudah ada endapan, namun laju pelarutan zat tersebut sebanding dengan laju pengendapan zat.
Konstanta hasil kali kelarutan juga dapat meramalkan pengendapan.
Bila dua larutan dicampurkan, maka akan terbentuk basa/garam yang akan larut/mengendap yang dapat dicek dengan kuosien reaksi (Qc). Kuosien reaksi (Qc) adalah nilai yang bentuk persamaannya sama dengan tetapan hasil kali kelarutan (Ksp).
Makna nilai kuosien reaksi:
- Jika Qc = Ksp, berarti larutan tepat jenuh (akan mengendap).
- Jika Qc < Ksp, berarti larutan tidak/belum mengendap.
- Jika Qc > Ksp, berarti telah terjadi pengendapan.
Reaksi pengendapan dari dua larutan merupakan pengenceran, sehingga nilai konsentrasi seluruh zat berubah.
Contoh:
Basa Mg(OH)2 mempunyai Ksp = 10-15. Apakah terbentuk endapan Mg(OH)2 jika 50 mL MgSO4 0,01 M dicampur dengan 50 mL NH4OH 0,1 M? (Kb NH4OH = 10-5 )
Jawab:

Ternyata Qc > Kc, maka telah terjadi endapan Mg(OH)2.
1.
Kerjakan dengan benar!
Kelarutan PbSO4 dalam air pada suhu tertentu adalah 1,4 x 10-4 mol/L. Massa PbSO4 yang dapat larut dalam 500 mL air adalah... (nyatakan jawaban dalam satuan miligram (mg))
(Ar Pb = 206; S = 32; O = 16)
A. 16,78 mg
B. 18,88 mg
C. 19,28 mg
D. 20,58 mg
E. 21,14 mg
JAWABAN BENAR
E.
21,14 mg
PEMBAHASAN
Data
V = 500 mL 0,5 L
s = 1,4 x 10-4 mol/L
Hubungan kelarutan, volume dan jumlah mol dan massa (gram) adalah
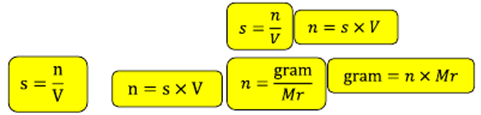
dimana
s = kelarutan (mol/L)
v = volume (L)
n = jumlah mol
Sehingga jumlah mol PbSO4
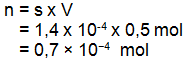
dan massanya adalah
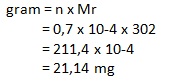
2.
Kerjakan dengan tepat!
Sebanyak 0,7 gram BaF2 (Mr = 175) melarut dalam air murni membentuk 2 L larutan jenuh. Ksp dari BaF2 adalah....
A. 1,7 x 10-7
B. 2,2 x 10-5
C. 3,2 x 10-8
D. 4,5 x 10-5
E. 5,6 x 10-2
JAWABAN BENAR
C.
3,2 x 10-8
PEMBAHASAN
Jumlah mol dari BaF2 adalah:
n = 0,7 / 175 = 4 x 10-3 mol
Kelarutannya adalah
S = 4 x 10-3 mol / 2 L = 2 x 10-3 mol/L
BaF2 <===> Ba2+ + 2F-
2 x 10-3 2 x 10-3 4 x 10-3
Ksp BaF2 = [Ba2+][F-]2
Ksp BaF2 = (2 x 10-3)(4 x 10-3)2
= 3,2 x 10-8
3.
Kerjakan dengan tepat!
Harga Ksp dari beberapa senyawa dan harga Qc yang diperoleh berdasarkan perhitungan ditunjukkan pada data sebagai berikut:
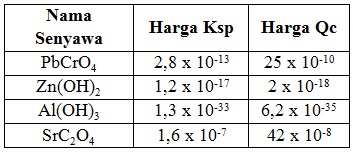
Endapan akan terbentuk pada senyawa....
A. Zn(OH)2 dan Al(OH)3
B. PbCrO4 dan Al(OH)3
C. PbCrO4 dan SrC2O4
D. Zn(OH)2 dan PbCrO4
E. SrC2O4 dan Al(OH)3
JAWABAN BENAR
C.
PbCrO4 dan SrC2O4
PEMBAHASAN
Syarat terbentuk endapan adalah Qc > Ksp. Berdasarkan data tersebut, maka senyawa yang terjadi endapan adalah PbCrO4 dan SrC2O4.
4.
Perhatikan soal berikut!
Jika tetapan hasil kali kelarutan lebih besar dari hasil kali konsentrasi ion-ion dalam larutan maka yang akan terjadi adalah....
A. terbentuk endapan
B. larutan tepat jenuh
C. larutan pekat
D. larutan jenuh
E. tidak terbentuk endapan
JAWABAN BENAR
E.
tidak terbentuk endapan
PEMBAHASAN
Jika Ksp > Qc atau Qc < Ksp maka tidak terbentuk endapan.
5.
Jawablah dengan benar!
Kelarutan AgBr dalam air adalah 5 x 10-15 mol/L. Apabila pada temperatur yang sama, AgBr dilarutkan dalam larutan MgBr2 0,2 M, maka kelarutannya adalah....
A. 5,2 x 10-30 mol/L
B. 1,4 x 10-30 mol/L
C. 6,5 x 10-29 mol/L
D. 6,25 x 10-29 mol/L
E. 3,75 x 10-28 mol/L
JAWABAN BENAR
D.
6,25 x 10-29 mol/L
PEMBAHASAN
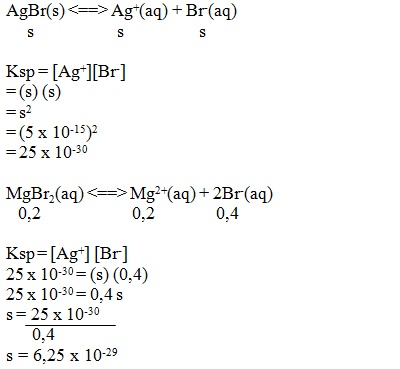
6.
Kerjakan dengan cermat!
Selidiki terbentuknya pengendapan, jika sebanyak 5×10-2 mol AgNO3 dan 10-3 NaCl dilarutkan sampai volume 300 mL! (Ksp AgCl = 10-5)
A. Qc < Ksp (tidak terjadi pengendapan)
B. Qc > Ksp (tidak terjadi pengendapan)
C. Ksp < Qc (terjadi pengendapan)
D. Qc = Ksp (terjadi pengendapan)
E. Qc > Qc (terjadi pengendapan)
JAWABAN BENAR
A.
Qc < Ksp (tidak terjadi pengendapan)
PEMBAHASAN

7.
Kerjakan dengan seksama!
Sebanyak 100 mL larutan MgCl2 0,01 M dicampurkan dengan 100 mL K2CO3 0,001 M. Jika diketahui Ksp dari MgCO3 adalah 3,5 x 10-5, apakah MgCO3 yang terbentuk sudah mengendap?
A. MgCO3 tidak mengendap
B. MgCO3 mengendap
C. MgCO3 sangat mengendap
D. MgCO3 lebih mengendap
E. MgCO tidak mengendap
JAWABAN BENAR
A.
MgCO3 tidak mengendap
PEMBAHASAN
Diketahui:
mmol MgCl2 = V (mL) x M = 100 mL x 0,01 M = 1 mmol
mmol K2CO3 = V (mL) x M = 100 mL x 0,001 M = 0,1 mmol
Dari hasil perhitungan, diperoleh Qc = 2,5 x 10-6
Dari data diketahui Ksp = 3,5 x 10-5
Karena Qc MgCO3 < Ksp MgCO3, maka MgCO3 tidak mengendap (larutan belum jenuh).

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


