Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Larutan Asam dan Basa
MATERI
Teori Arrhenius (oleh Svante August Arrhenius)

Sobat Pintar, menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika dilarutkan dalam air dapat membebaskan H+ (ion hidrogen) atau dengan kata lain sifat pembawa asamnya adalah ion H+. Basa didefinisikan sebagai senyawa yang jika dilarutkan dalam air dapat membebaskan OH- (ion hidroksida) Sifat pembawa basanya adalah ion OH-.
Reaksi ionisasi asam dalam air
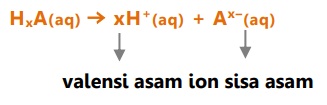
Contoh:
Asam klorida = HCl --> H+ + Cl-
Asam sulfida = H2S --> 2H+ + S2-
Reaksi ionisasi basa dalam air
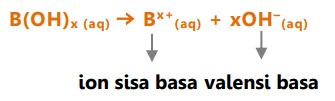
Contoh:
Natrium hidroksida = NaOH --> Na+ + OH-
Magnesium hidroksida = Mg(OH)2 --> Mg2+ + 2OH-
Teori Bronsted Lowry (oleh Bronsted dan Lowry)

Menurut Bronsted-Lowry, asam dan basa hanya terionisasi dalam air karena:
- Air menarik ion H+ sehingga membentuk ion hidronium (H3O+),
- Air melepas ion H+ sehingga membentuk ion hidroksida (OH-).
Sehingga diperoleh dasar teori asam dan basa: pertukaran proton (H+)
- Asam: sebagai donor (pemberi) proton
- Basa: sebagai akseptor (penerima) proton
Menurut teori asam-basa Bronsted-Lowry:
- Asam yang telah melepaskan satu proton akan membentuk spesi atau zat yang disebut basa konjugasi.
Contoh:

- Basa yang telah menerima satu proton akan membentuk spesi atau zat yang disebut asam konjugasi.
Contoh:
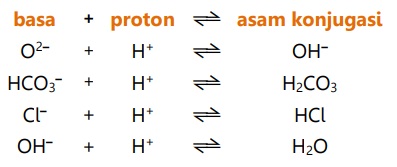
Lebih singkatnya, Johanes N. Bronsted dan Thomas M Lowry menyimpulkan bahwa :
Asam = donor proton
Basa = akseptor proton
Teori Lewis (oleh Lewis)

Menurut Lewis, transfer proton terjadi karena adanya pasangan elektron bebas pada basa, yang kemudian akan membentuk ikatan kovalen koordinasi dengan proton tersebut.
Teori asam basa Lewis:
- Asam adalah spesi atau zat akseptor pasangan elektron.
- Basa adalah spesi atau zat donor pasangan elektron.
Contoh:
- HNO3
Asam : atom O
Basa : atom N
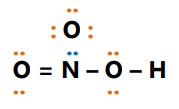
- H2SO4
Asam : atom O
Basa : atom S
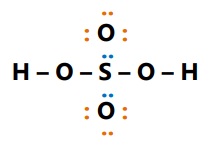
- NH3 + BF3 --> NH3BF3
Asam : atom B pada BF3
Basa : atom N pada NH3
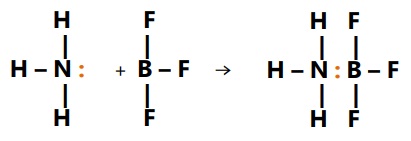
1.
Perhatikan soal berikut!
Terdapat tiga macam teori yang mengemukakan asam dan basa, salah satunya adalah...
A. Teori Lewis dan Teori Arrhenius
B. Teori Lewis dan Teori Bohr
C. Teori Arrhenius dan Teori Bohr
D. Teori Bronsted Lowry dan Teori Newton
E. Teori Bronsted Lowry dan Teori Darwin
JAWABAN BENAR
A.
Teori Lewis dan Teori Arrhenius
PEMBAHASAN
Tiga macam teori yang mengemukakan asam dan basa adalah Teori Arrhenius, Teori Bronsted Lowry, dan Teori Lewis
2.
Perhatikan soal berikut!
Teori Arrhenius mengemukakan sebuah reaksi asam basa, yaitu...
A. Reaksi perpindahan proton dari asam ke basa
B. Reaksi membentuk asam dan basa konjugasi
C. Reaksi penetralan
D. Reaksi pembentukan senyawa
E. Reaksi pembentukan senyawa kompleks
JAWABAN BENAR
C.
Reaksi penetralan
PEMBAHASAN
Teori Arrhenius menggunakan :
Reaksi asam basa : Reaksi penetralan
- Penggabungan ion H+ dan OH- membentuk air
- Kation yang terikat pada OH- dan anion yang terikat pada H+ membentuk senyawa ionik
3.
Kerjakan soal berikut!
Larutan dalam air senyawa berikut yang tidak dapat menghasilkan ion OH- adalah....
A. KOH
B. NaOH
C. Mg(OH)2
D. NH3
E. CH3COOH
JAWABAN BENAR
E.
CH3COOH
PEMBAHASAN
Reaksi senyawa di atas dengan air dapat ditulis sebagai berikut.
- KOH, NaOH, dan Mg(OH)2 adalah basa yang di dalam air akan terionisasi menghasilkan OH-.
- NH3 + H2O --> NH4+ + OH-
- CH3COOH adalah asam lemah yang di dalam air terionisasi menghasilkan ion CH3COO- dan H+.
4.
Perhatikan soal berikut!
Diketahui reaksi-reaksi :
- H3PO4(aq) --> H2PO4-(aq) + H+(aq)
- HS-(aq) + H+(aq) --> H2S(aq)
- SO32-(aq) + HNO3(aq) --> HSO3-(aq) + NO3-(aq)
- NH3(aq) + H2O(l) --> NH4+(aq) + OH-(aq)
Pasangan yang kedua spesinya berfungsi sebagai asam menurut konsep Bronsted-Lowry
adalah....
A. H3PO4 dan HS-
B. HS- dan NH3
C. H3PO4 dan H2O
D. H2O dan HS-
E. NO3 dan SO32-
JAWABAN BENAR
C.
H3PO4 dan H2O
PEMBAHASAN
Teori Asam-Basa menurut Bronsted-Lowry menyatakan:
Asam : suatu zat yang memberikan proton (H+) kepada zat lain
Basa.: suatu zat yang menerima proton (H+) dari zat lain.
- H3PO4(aq) --> H2PO4-(aq) + H+(aq)
H3PO4(aq) : sebagai asam, karena memberikan H+ - HS-(aq) + H+(aq) --> H2S(aq)
HS-(aq) : sebagai basa, karena menerima H+ - SO32-(aq) + HNO3(aq) --> HSO3-(aq) + NO3-(aq)
SO32-(aq) : sebagai basa, karena menerima H+ - NH3(aq) + H2O(l) --> NH4+(aq) + OH-(aq)
NH3(aq) : sebagai basa, karena menerima H+
H2O : sebagai asam, karena memberikan H+
5.
Perhatikan soal berikut!
Pernyataan yang benar mengenai teori asam-basa Lewis adalah....
A. Asam adalah penerima pasangan elektron bebas
B. Basa adalah aseptor pasangan elektron bebas
C. Asam adalah yang melepaskan ion H+
D. Basa adalah yang menangkap ion OH-
E. Asam adalah pendonor proton
JAWABAN BENAR
A.
Asam adalah penerima pasangan elektron bebas
PEMBAHASAN
Pernyataan yang benar adalah:
Asam adalah penerima pasangan elektron bebas.
6.
Kerjakan soal dengan benar!
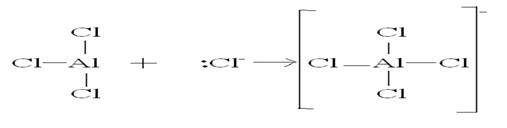
Perhatikan reaksi berikut:
AlCl3 + Cl- --> AlCl4-
Manakah spesi yang bertindak sebagai asam Lewis?
A. AlCl3
B. Cl-
C. AlCl4-
D. OH-
E. H+
JAWABAN BENAR
A.
AlCl3
PEMBAHASAN
Menurut Lewis:
• Asam: zat/senyawa yang dapat menerima pasangan elektron bebas dari zat/senyawa lain.
• Basa: zat/senyawa yang dapat mendonorkan pasangan elektron bebas dari zat/senyawa lain.
jika reaksi diatas digambarkan dengan rumus Lewis, maka senyawa AlCl3 akan bertindak sebagai asam lewis
7.
Kerjakan soal dengan tepat!
Di bawah ini yang termasuk pernyataan dari Gilbert N. Lewis yaitu ...
A. Asam merupakan akseptor pasangan elektron dan basa adalah donor pasangan elektron
B. Basa merupakan akseptor pasangan elektron dan asam adalah donor pasangan elektron
C. Basa merupakan akseptor pasangan elektron dan asam adalah donor pasangan elektron
D. Basa merupakan akseptor pasangan elektron dan basa adalah donor pasangan elektron
E. Basa adalah senyawa yang dalam air dapat menghasilkan ion hidroksida (OH-)
JAWABAN BENAR
A.
Asam merupakan akseptor pasangan elektron dan basa adalah donor pasangan elektron
PEMBAHASAN
Lewis memberikan pengertian asam dan basa berdasarkan serah terima pasangan elektron berikut :
Asam = akseptor pasangan elektron
Basa = donor pasangan elektron

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


