Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Larutan Asam dan Basa
MATERI
Mengenal Asam dan Basa

Asam
Coba perhatikan gambar berikut!

Gambar di atas merupakan salah satu contoh asam di mana jeruk mengandung vitamin C dengan nama senyawanya adalah asam askorbat.
Ciri-ciri asam
Secara umum asam memiliki ciri-ciri sebagai berikut:
- Rasa masam jika dicicipi (jangan menguji asam kuat dengan mencicipinya)
- Derajat keasaman lebih kecil dari 7 (pH < 7)
- Terasa menyengat jika disentuh, terutama asam kuat
- Reaksi dengan logam bersifat korosif (menyebabkan karat, dapat pula merusak jaringan kulit/iritasi dan melubangi benda yang terbuat dari kayu atau kertas jika konsentrasinya tinggi)
- Merupakan larutan elektrolit sehingga dapat menghantarkan arus listrik.
Sifat asam:
- Mempunyai rasa asam
- Mengubah lakmus biru menjadi merah
- Bersifat korosif, dapat melarutkan berbagai logam
- Dapat melarutkan batu kapur menghasilkan gas karbon dioksida.
Basa
Perhatikan gambar berikut!

Gambar di atas merupakan salah satu contoh basa di mana sabun dibuat dengan menggunakan NaOH atau natrium hidroksida sebagai penyusun sabun.
Ciri-ciri basa
Secara umum basa memiliki ciri-ciri sebagai berikut:
- Rasa pahit jika dicicipi
- Dalam keadaan murni umumnya berupa kristal padat
- Tingkat keasaman lebih besar dari 7 (pH > 7)
- Terasa licin di kulit (jangan menguji basa kuat dengan menyentuhnya)
- Memiliki sifat kaustik, yaitu merusak kulit jika kadar basanya tinggi
- Dapat mengemulsi minyak
- Merupakan elektrolit, larutannya dapat menghantarkan arus listrik
Sifat basa:
- Rasanya pahit
- Mengubah lakmus merah menjadi biru
- Bereaksi dengan lemak membentuk sabun.
- Menetralkan sifat asam
- Bersifat korosif, khususnya basa kuat.
pH dan pOH

pH
pH (puissance de H+) adalah derajat asam-basa larutan yang diukur berdasarkan [H+] larutan.
Nilai pH dapat dirumuskan:

Kisaran umum nilai pH larutan:
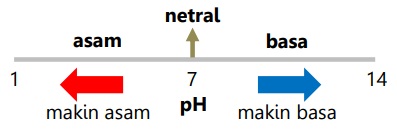
Makna nilai pH larutan:
- Semakin besar [H+] maka makin kecil nilai pH.
- Keasaman berbanding terbalik dengan nilai pH, kebasaan berbanding lurus dengan nilai pH.
- Larutan dengan pH < 7 bersifat asam, pH = 7 bersifat netral, dengan pH > 7 bersifat basa.
pOH
pOH (puissance de OH-) adalah derajat asam-basa larutan yang diukur berdasarkan [OH-] larutan.
Nilai pOH dapat dirumuskan:
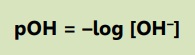
Kisaran umum nilai pOH larutan:
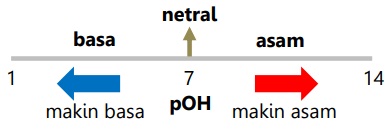
Makna nilai pOH larutan:
- Semakin besar [OH-] maka makin kecil nilai pOH.
- Kebasaan berbanding terbalik dengan nilai pOH, keasaman berbanding lurus dengan nilai pOH.
- Larutan dengan pOH < 7 bersifat basa, pOH = 7 bersifat netral, dengan pOH > 7 bersifat asam.
Asam Basa Kuat

Asam dan basa disebut kuat apabila:
- Mudah terion karena ikatan antar atom mudah lepas akibat jarak antar inti atom pada molekul yang sangat jauh.
- Memiliki derajat ionisasi = 1 atau terion sempurna.
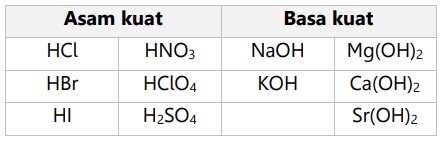
Golongan asam dan basa kuat:
Nilai konsentrasi H+ dan OH- asam-basa kuat:

Pengenceran pada asam dan basa kuat:
- Dua larutan asam atau basa kuat yang berbeda konsentrasi sebesar 10n kali memiliki beda pH sebesar n satuan.
- Jika asam kuat diencerkan sebesar 10n kali, maka pHnya naik n satuan.
- Jika basa kuat diencerkan sebesar 10n kali, maka pHnya turun n satuan.
Asam Basa Lemah

Asam dan basa disebut lemah apabila:
- Sukar terion karena ikatan antar ion sulit lepas akibat jarak antar inti atom pada molekul yang sangat dekat.
- Memiliki derajat ionisasi lebih kecil dari 1 dan lebih besar dari 0 atau terion sebagian, sehingga terjadi kesetimbangan.
Golongan asam dan basa lemah adalah selain dari golongan asam dan basa kuat.
Reaksi ionisasi asam-basa lemah merupakan reaksi kesetimbangan yang memiliki nilai konstanta ionisasi asam-basa (Ka dan Kb).
Bentuk umum tetapan ionisasi asam:
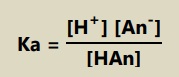
Contoh:
Pada reaksi ionisasi CH3COOH, tetapan ionisasi asam:
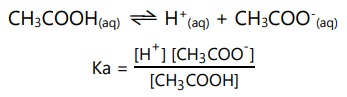
Semakin besar nilai Ka, maka akan semakin kuat sifat suatu asam.
Bentuk umum tetapan ionisasi basa:

Contoh:
Pada reaksi ionisasi Mg(OH)2, tetapan ionisasi basa:
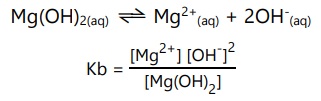
Semakin besar nilai Kb, maka akan semakin kuat sifat suatu basa.
Nilai konsentrasi H+ dan OH- asam-basa lemah:
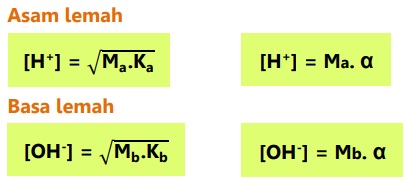
Hubungan derajat ionisasi dengan tetapan ionisasi asam-basa:
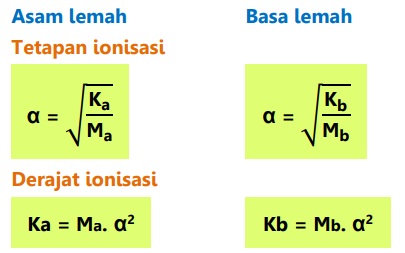
Hubungan nilai tetapan ionisasi asam-basa dan pasangan konjugasinya dengan Kw = 10-14:
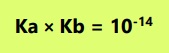
Indikator Asam Basa

Indikator asam-basa adalah zat yang digunakan untuk mengidentifikasi sifat asam-basa suatu larutan/zat. Indikator asam-basa merupakan asam lemah atau basa lemah organik yang warna molekul dengan warna ionnya berbeda.
Indikator asam-basa yang dapat digunakan:
- Mengalami perubahan warna yang jelas ketika ditetesi asam atau basa.
- Indikator alami berupa ekstrak warna dari bunga berwarna terang/menyala.
Warna indikator asam-basa berubah secara gradual dari pH ke pH dan memiliki trayek perubahan warna. Trayek perubahan warna adalah batas-batas pH dimana indikator mengalami perubahan warna.
Macam-macam indikator asam-basa:
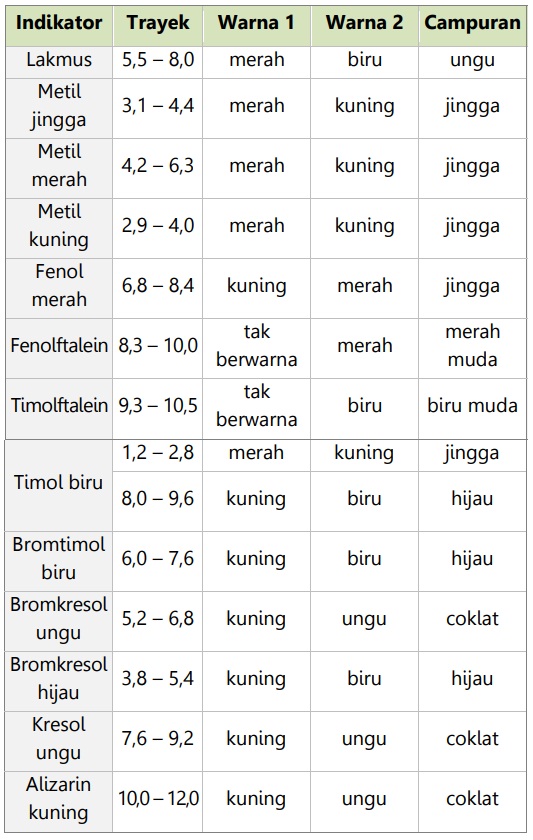
Warna campuran adalah gabungan warna 1 dan warna 2, dan muncul ketika suatu larutan pHnya berada dalam trayek perubahan warna.
1.
Kerjakan soal berikut!
Tentukan pH dari suatu larutan yang memiliki konsentrasi ion H+ sebesar 10-4 M!
A. 3
B. 4
C. 5
D. 6
E. 7
JAWABAN BENAR
B.
4
PEMBAHASAN
Menghitung pH larutan atau pOH larutan.
Diketahui data:
[H+] = 10-4, dengan rumus yang pertama untuk mencari pH

Sehingga:
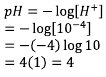
Ingat kembali rumus logaritma:
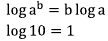
pH larutan adalah 4.
2.
Perhatikan soal berikut!
Tentukan pH dari suatu larutan yang memiliki konsentrasi ion H+ sebesar 2 x 10-4 M. Gunakan nilai log 2 = 0,3
A. 3,7
B. 4,7
C. 5,7
D. 6,7
E. 7,7
JAWABAN BENAR
A.
3,7
PEMBAHASAN
[H+ ] = 2 x 10-4, dengan rumus yang sama,
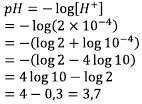
Ingat sifat log berikut
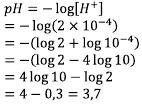
3.
Perhatikan soal berikut!
Yang dimaksud dengan asam kuat adalah....
A. asam yang tepat melarutkan logam
B. asam yang dalam rumus kimianya banyak mengandung atom H
C. asam yang jika dilarutkan dalam air dapat menghantarkan arus listrik
D. asam yang dapat memerahkan lakmus biru
E. asam yang jika dilarutkan dalam air banyak menghasilkan ion H+
JAWABAN BENAR
E.
asam yang jika dilarutkan dalam air banyak menghasilkan ion H+
PEMBAHASAN
Asam kuat adalah asam yang memiliki derajat ionisasi sama dengan 1 atau mendekati 1. Jika dilarutkan dalam air asam kuat akan terionisasi sempurna menghasilkan H+ dan ion sisa asam.
4.
Jawablah soal berikut ini!
Suatu larutan basa lemah MOH mempunyai konsentrasi 0,1 M. Jika tetapan ionisasi (Kb) basa lemah itu 10-5 maka pH larutan itu adalah....
A. 3
B. 11
C. 7 - log 5
D. 11 + log 5
E. 7 + log 5
JAWABAN BENAR
B.
11
PEMBAHASAN
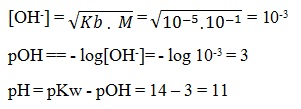
5.
Perhatikan soal berikut!
Besarnya pH larutan 0,74 gram Ca(OH)2 (Ar Ca = 40, O = 16, dan H = 1) dalam 500 mL larutan adalah ....
A. 2 - log 4
B. 2 + log 4
C. 11 + log 4
D. 12 - log 4
E. 12 + log 4
JAWABAN BENAR
E.
12 + log 4
PEMBAHASAN
Diketahui:
Massa Ca(OH)2 = 0,74 gram
Volume Ca(OH)2 = 500 mL
(Ar Ca = 40, O = 16, dan H = 1)
Ditanya : pH = ...?
Jawab :
M Ca(OH)2 = (massa/mr) x (1000/v)
M Ca(OH)2 = (0,74/74) x (1000/500)
M Ca(OH)2 = 0,02 M
[OH-] = 2 x [Ca(OH)2] = 2 x 0,02 M
[OH-] = 0,04 M
pOH = - log[OH-]
pOH = - log 0,04
pOH = 2 - log 4
pH = 14 - (2 - log 4)
pH = 12 + log 4
6.
Kerjakan soal dengan benar!
Tabel berikut merupakan data pengujian beberapa larutan menggunakan beberapa indikator.
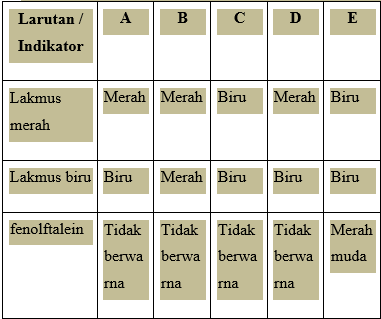
Pernyataan yang tepat yang berkaitan dengan data tersebut yaitu ...
A. Larutan A bersifat asam
B. Larutan B bersifat basa
C. Larutan C bersifat basa
D. Larutan D bersifat basa
E. Larutan E bersifat netral
JAWABAN BENAR
C.
Larutan C bersifat basa
PEMBAHASAN
Berikut hasil uji kertas lakmus terhadap senyawa asam, basa dan garam.
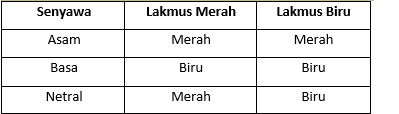
Berdasarkan hal itu, maka dapat disimpulkan bahwa larutan A bersifat netral, larutan B bersifat asam, larutan C bersifat basa, larutan D bersifat netral, dan larutan E bersifat Basa.
7.
Kerjakan dengan benar!
Jika ke dalam air kapur ditetesi indikator bromtimol biru, maka warna air kapur akan berubah menjadi ...
A. Biru
B. Kuning
C. Merah
D. Hijau
E. Jingga
JAWABAN BENAR
A.
Biru
PEMBAHASAN
Bromtimol biru adalah salah satu indikator asam basa berbentuk larutan. Indikator ini memiliki trayek pH 6,0 - 7,8 dengan perubahan warna kuning - biru. Artinya adalah jika suatu larutan menunjukkan warna kuning ketika ditetesi bromtimol biru, maka pH larutan itu adalah kecil dari 6 sedangkan jika larutan menunjukkan warna biru maka pH larutan besar dari 7,8. Jika larutan misalnya berada diatanra trayek pH tersebut (misalkan pH = 7) maka larutan akan menunjukkan kombinasi warna kuning dan biru.
Air kapur adalah senyawa basa dengan rumus kimia Ca(OH)2 merupakan senyawa basa kuat yang pasti pH nya besar dari 7. Maka jika bromtimol biru ditetesi pada larutan ini maka akan berubah menjadi warna biru yang menunjukkan sifat basa.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


