Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Larutan Asam dan Basa
MATERI
Pengertian Titrasi Asam Basa

Titrasi, yaitu merupakan sebuah metode yang dapat digunakan untuk menentukan suatu konsentrasi sebuah larutan. Caranya adalah dengan menetesi (menambahi sedikit demi sedikit) larutan yang akan dicari konsentrasinya (analit) dengan sebuah larutan hasil standarisasi yang sudah dapat diketahui konsentrasi dan volumenya (titrant) sampai ia tepat habis bereaksi (titik ekuivalen) yang dibantu oleh indikator asam-basa. Titrasi (penetesan) dihentikan tepat pada saat indikator asam-basa menunjukkan perubahan warna (titik akhir titrasi).
Titrasi Asam Basa, yaitu merupakan penentuan kadar suatu larutan basa dengan larutan asam yang ingin diketahui kadarnya atau sebaliknya, kadar suatu larutan asam dengan larutan basa yang ingin diketahui, dengan didasarkan pada reaksi netralisasi.
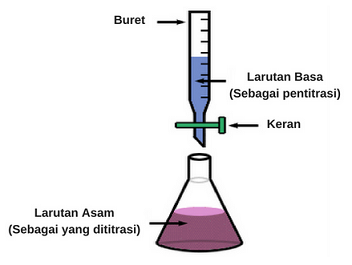
Menetapkan kadar suatu larutan dengan mereaksikan sejumlah larutan tersebut yang volumenya terukur dapat kita ukur dengan suatu larutan lain yang telah diketahui kadarnya (larutan standar) dan juga secara bertahap.
Perubahan pH Pada Titrasi

Pada saat larutan basa sedang ditetesi dengan larutan asam, pH larutan pun akan turun, dan sebaliknya jika larutan asam sedang ditetesi dengan larutan basa, maka pH pun larutan akan naik.
Jika suatu pH larutan asam basa telah diplotkan sebagai fungsi dari volum larutan basa atau asam tersebut yang sudah diteteskan, maka akan diperoleh suatu grafik yang bisa disebut kurva titrasi.
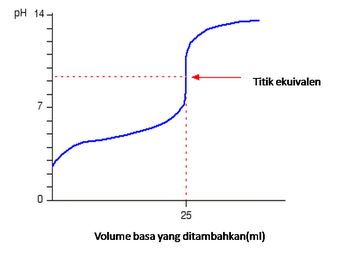
Kurva titrasi dapat menunjukkan suatu perubahan pH larutan selama proses titrasi asam dengan basa berlangsung atau sebaliknya. Bentuk kurva titrasi sendiri memiliki karakteristik tertentu yang bergantung pada kekuatan dan konsentrasi asam dan basa yang bereaksi.
Titrasi Asam Kuat Dengan Basa Kuat

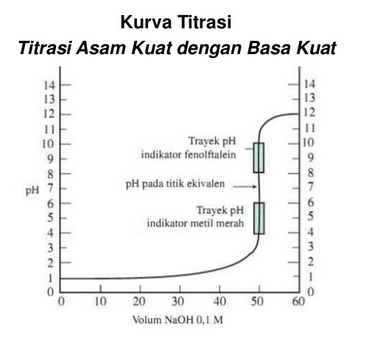
Kurva diatas dapat kita simpulkan sebagai contoh perubahan pH, yaitu sebagai berikut :
- Pertama kita lihat pH larutan naik sedikit demi sedikit.
- Perubahan pH drastis akan terjadi pada titik ekivalen.
- pH titik ekivalennya = 7 (netral).
- Indikator yang dapat digunakan: metil merah, bromtimol biru, atau fenolftalein.
- Namun, yang lebih sering digunakan adalah fenolftalein karena pada perubahan warna fenolftalein yang lebih mudah diamati.
Titrasi Asam Lemah Dengan Basa Kuat

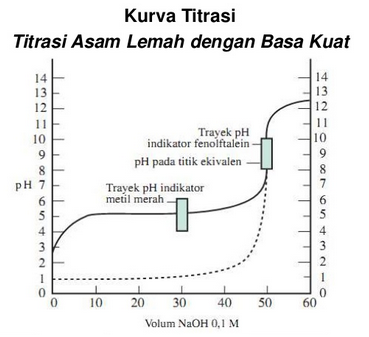
Kurva diatas dapat kita simpulkan sebagai contoh perubahan pH, yaitu sebagai berikut :
- Dapat dilihat titik ekivalen berada di atas pH 7, yaitu antara 8 – 9.
- Lonjakan perubahan pH pada sekitar titik ekivalen akan lebih kecil, tetapi hanya sekitar 3 satuan, yaitu dari pH ±7 hingga pH ±10.
- Indikator yang dapat digunakan : fenolftalein.
- Metil merah tidak dapat digunakan karena perubahan warnanya terjadi jauh sebelum tercapai titik ekivalennya.
Titrasi Basa Lemah Dengan Asam Kuat

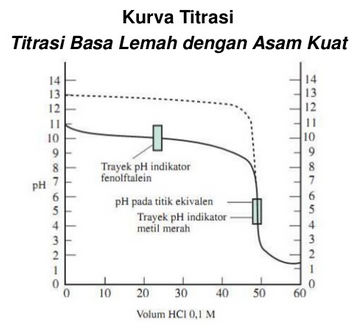
Kurva diatas dapat kita simpulkan sebagai contoh perubahan pH, yaitu sebagai berikut :
- Dapat kita lihat titik ekivalen berada di bawah pH 7, yaitu antara 5 – 6.
- Pada lonjakan perubahan pH pada sekitar titik ekivalen hanya sedikit, sekitar 3 satuan, yaitu dari pH ±7 hingga pH ±4
- Indikator yang dapat digunakan : metil merah.
- Fenolftalein tidak dapat digunakan karena perubahan warnanya akan terjadi jauh sebelum tercapai titik ekivalen.
Menentukan Kadar Larutan yang Dititrasi

Ma = molaritas asam
1.
Perhatikan soal berikut!
Dalam titrasi asam basa, larutan hasil standarisasi yang sudah dapat diketahui konsentrasi dan volumenya disebut....
A. ekivalen
B. larutan standar
C. titrant
D. larutan asam
E. larutan basa
JAWABAN BENAR
C.
titrant
PEMBAHASAN
Larutan hasil standarisasi yang sudah dapat diketahui konsentrasi dan volumenya disebut dengan Titrant.
2.
Perhatikan soal berikut!
Di antara indikator berikut, yang bukan merupakan indikator dalam titrasi asam basa adalah....
A. larutan iodin
B. metil merah
C. bromtimol biru
D. fenolftalein
E. indikator universal
JAWABAN BENAR
A.
larutan iodin
PEMBAHASAN
Indikator dalam titrasi asam basa diantaranya adalah:
- metil merah
- bromtimol biru
- fenolftalein
- indikator universal
3.
Kerjakan soal berikut!
Istilah penetralan ada kaitannya dengan....
A. reaksi antara asam dengan basa
B. penggunaan pipet untuk menambahkan asam atau basa ke dalam suatu wadah
C. reaksi antara ion hidrogen dengan air
D. pengambilan zat terlarut dari suatu larutan
E. reaksi antara ion hidrogen dengan ion hidroksida
JAWABAN BENAR
A.
reaksi antara asam dengan basa
PEMBAHASAN
Karena penetralan akan terjadi apabila asam dan basa seimbang dan pH = 7 juga menghasilkan garam dan air.
4.
Perhatikan soal berikut!
Pada penetapan kadar larutan CH3COOH dengan larutan NaOH sebaiknya menggunakan indikator....
A. fenolftalein (trayek pH: 8,3 – 10,0)
B. metil merah (trayek pH: 4,2 – 6,3)
C. alizarin kuning (trayek pH: 10,1 – 12,0)
D. metil oranye (trayek pH: 2,9 – 4,0)
E. fenolftalein atau metil merah
JAWABAN BENAR
C.
alizarin kuning (trayek pH: 10,1 – 12,0)
PEMBAHASAN
Zat yang bersangkutan adalah asam lemah yang dititrasi dengan basa kuat, maka indikator yang harus digunakan adalah indikator yang pH-nya cenderung basa.
5.
Perhatikan grafik titrasi asam-basa berikut!
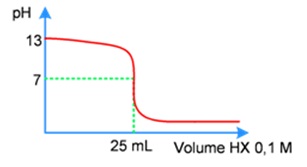
Jika volume larutan yang dititrasi sebanyak 10 mL maka konsentrasi larutan basa LOH itu adalah...
A. 0,25 M
B. 0,125 M
C. 0,1 M
D. 0,075 M
E. 0,025 M
JAWABAN BENAR
A.
0,25 M
PEMBAHASAN
Dari kurva di atas terlihat bahwa titik ekivalen terjadi saat volume asam HX adalah 25 mL.
Data yang diperlukan:
Asam HX
Va = 25 mL
Ma = 0,1 M
na = 1
Basa LOH
Vb = 10 mL
Mb = .....?
nb = 1
Konsentrasi LOH dengan demikian adalah
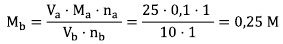
6.
Kerjakan dengan benar!
Sebanyak 20 ml sampel mengandung NaOH dititrasi dengan HCl 0,1 M. Volume titran yang dibutuhkan untuk mencapai titik ekuivalen yaitu sebanyak 18 ml. Berapakah konsentrasi NaOH dalam sampel tersebut?
A. 0,9M
B. 0,09M
C. 9M
D. 90M
E. 0,009M
JAWABAN BENAR
B.
0,09M
PEMBAHASAN
MHCl x VHCl = MNaOH x VNaOH
0,1 M x 18 ml = MNaOH x 20 ml
MNaOH = 0,1 M x 18 ml / 20 ml
= 0,09 M
7.
Kerjakan dengan benar!
Untuk memperoleh konsentrasi ion Cl- 0,1M maka ke dalam 250 mL larutan MgCl2 0,15M harus ditambah air. Berapa mL air yang harus ditambahkan?
A. 900 mL
B. 50 mL
C. 500 mL
D. 80 mL
E. 90 mL
JAWABAN BENAR
C.
500 mL
PEMBAHASAN


Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


