Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Larutan Penyangga
MATERI
Pengertian Larutan Penyangga

Larutan penyangga adalah suatu sistem larutan yang dapat mempertahankan nilai pH larutan agar tidak terjadi perubahan pH yang berarti oleh karena penambahan asam atau basa maupun pengenceran. Larutan ini disebut juga dengan larutan buffer atau dapar.
Larutan penyangga adalah:
Campuran asam lemah dengan garamnya atau basa konjugasinya.
Contoh:
CH3COOH dengan CH3COONa
CH3COOH dengan CH3COO-
Campuran basa lemah dengan garamnya atau asam konjugasinya.
Contoh:
NH4OH dengan NH4Cl
NH4OH dengan NH4+
Sifat larutan penyangga:
- pH larutan tidak berubah jika diencerkan.
- pH larutan tidak berubah jika ditambahkan ke dalamnya sedikit asam atau basa.
Larutan Penyangga Asam

Larutan penyangga asam dapat mempertahankan pH < 7, tersusun atas campuran:
- Asam lemah dan garamnya
Contoh: CH3COOH dengan CH3COONa - Asam lemah dan basa konjugasinya
Contoh: CH3COOH dengan CH3COO–
Larutan penyangga asam dapat dibuat dengan mereaksikan asam lemah dengan sedikit basa kuat. Reaksi tersebut akan menghasilkan garam atau basa konjugasi, menghabiskan basa kuat dan menyisakan asam lemah.
Contoh:
Larutan penyangga dari 100 mL H2CO3 0,3 M dan 100 mL NaOH 0,1 M,
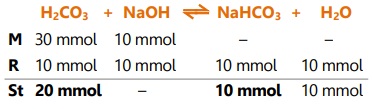
Larutan penyangga asam juga dapat dibuat dengan mencampurkan asam lemah dan garamnya yang merupakan basa konjugasi dari asam lemah.
Contohnya :
Larutan CH3COOH + larutan NaCH3COO (komponen penyangganya : CH3COOH dan CH3COO-)
Cara larutan penyangga asam menjaga pH:
- Pada penambahan asam (penambahan H+), kesetimbangan bergeser ke kiri, asam bereaksi dengan basa membentuk asam lemah.
- Pada penambahan basa (penambahan OH-), kesetimbangan bergeser ke kanan, basa bereaksi dengan asam membentuk air.
Konsentrasi H+ dalam larutan penyangga asam:
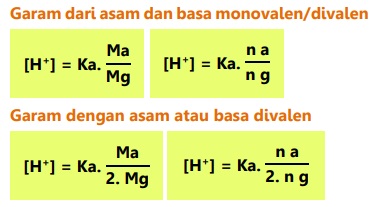
Contoh:
100 mL larutan penyangga mengandung 10 mmol H2S dan HS-. (Ka H2S = 1 x 10-6). Tentukan pH larutan:
- pH larutan penyangga

- Jika ditambahkan HCl 0,1 M 2 mL
Asam akan bereaksi dengan HS- (basa)

- Jika ditetesi KOH 0,1 M 3 mL
Basa akan bereaksi dengan H2S (asam),

Larutan Penyangga Basa

Larutan penyangga basa dapat mempertahankan pH > 7, tersusun atas campuran:
- Basa lemah dan garamnya
Contoh: NH3 dengan NH4Cl. - Basa lemah dan asam konjugasinya
Contoh: NH3 dengan NH4+
Larutan penyangga basa dapat dibuat dengan mereaksikan sedikit asam kuat dengan basa lemah. Reaksi tersebut akan menghasilkan garam atau asam konjugasi, menghabiskan asam kuat dan menyisakan basa lemah.
Contoh:
Larutan penyangga dari 250 mL NH3 0,1 M dan 100 mL HCl 0,1 M,
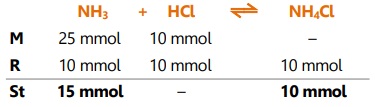
Larutan penyangga juga dapat dibuat dengan mencampurkan suatu basa lemah dengan garamnya.
Contoh:
Larutan NH3 + larutan NH4Cl (komponen penyangganya : NH3 dan NH4+)
Cara larutan penyangga basa menjaga pH:
- Pada penambahan asam (penambahan H+), kesetimbangan bergeser ke kanan, asam bereaksi dengan basa membentuk asam lemah.
- Pada penambahan basa (penambahan OH-), kesetimbangan bergeser ke kiri, basa bereaksi dengan asam membentuk air.
Konsentrasi OH- dalam larutan penyangga basa:
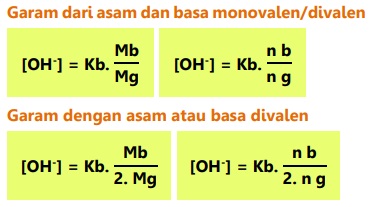
Contoh:
100 mL larutan penyangga mengandung NH3 dan NH4Cl yang keduanya 0,1 M. (Kb NH3 = 10-5). Tentukan pH larutan:
- pH larutan penyangga
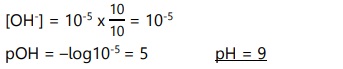
- Jika ditambahkan HCl 0,1 M 3 mL
Asam akan bereaksi dengan NH3 (basa),
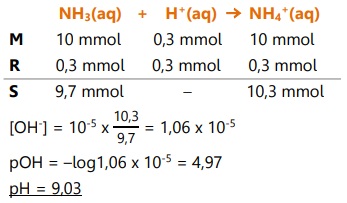
- Jika ditetesi KOH 0,1 M 4 mL
Basa akan bereaksi dengan NH4+ (asam),
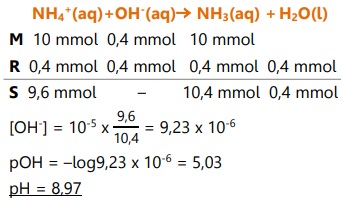
Fungsi Larutan Penyangga

Larutan penyangga digunakan dalam:
- Analisis zat kimia dan biokimia
- Laboratorium bakteriologi
- Kultur jaringan
- Obat tablet dan cair
- Cocok tanam hidroponik
Larutan penyangga terdapat dalam tubuh manusia yang berfungsi menjadi keseimbangan pH tubuh, terdapat pada cairan intrasel dan cairan ekstrasel (misalnya darah dan air liur).
Macam-macam larutan penyangga dalam tubuh:
- Penyangga fosfat tersusun atas H2PO4- dan HPO42- dan berada pada seluruh cairan tubuh.
Pada penurunan pH tubuh
HPO4-(aq) + H+(aq) --> H2PO4-(aq)
Pada kenaikan pH tubuh
H2PO4-(aq) + OH-(aq) --> HPO4-(aq) + H2O(l) - Penyangga karbonat tersusun atas H2CO3 dan HCO3- dan berada pada darah.
Pada penurunan pH tubuh
HCO3-(aq) + H+(aq) --> H2CO3(aq)
Pada kenaikan pH tubuh
H2CO3(aq) + OH-(aq) --> HCO3-(aq) + H2O(l) - Penyangga hemoglobin tersusun atas HHb dan HbO2 dan berada pada darah.
Kesetimbangan hemoglobin
HHb(aq) + O2(aq) --> HbO2(aq) + H+(aq)
Tanpa larutan penyangga, tubuh manusia dapat mengalami asidosis dan alkalosis yang menyebabkan kerusakan jaringan dan organ.
1.
Kerjakan soal berikut!
Yang termasuk contoh campuran asam lemah dengan garam dari asam lemah adalah...
A. CH3COOH dengan NH4OH
B. H3PO4 dengan CH3COOH
C. CH3COONa dengan NaH2PO4
D. CH3COOH dengan CH3COONa
E. NH4OH dengan NH4Cl
JAWABAN BENAR
D.
CH3COOH dengan CH3COONa
PEMBAHASAN
Contoh campuran asam lemah dengan garam dari asam lemah :
- CH3COOH dengan CH3COONa
- H3PO4 dengan NaH2PO4
2.
Kerjakan soal di bawah!
Yang termasuk sifat larutan buffer adalah....
A. pH larutan tidak berubah jika diencerkan
B. pH larutan encer jika berubah
C. pH larutan berubah menjadi padat jika dipanaskan
D. pH larutan berubah jika ditambahkan sedikit asam
E. pH larutan berubah jika ditambahkan sedikit basa
JAWABAN BENAR
A.
pH larutan tidak berubah jika diencerkan
PEMBAHASAN
Sifat larutan buffer:
- pH larutan tidak berubah jika diencerkan.
- pH larutan tidak berubah jika ditambahkan ke dalamnya sedikit asam atau basa.
3.
Perhatikan soal berikut!
Diketahui pasangan pasangan larutan berikut.
- NaF dan HF
- HCOOH dan HCOONH4
- NH3 dan NH4Cl
- HCl dan MgCl2
Pasangan yang merupakan larutan penyangga terdapat pada nomor ....
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
JAWABAN BENAR
B.
1 dan 3
PEMBAHASAN
NaF dan HF merupakan larutan penyangga asam karena terbentuk dari asam lemah dengan garam konjugasinya, sedangkan NH3 dan NH4Cl merupakan larutan penyangga basa karena terbentuk dari basa lemah dan garam konjugasinya.
4.
Kerjakan soal berikut!
Tentukan pH larutan apabila 400 ml larutan NH4OH 0,5 M dicampur dengan 100 ml larutan NH4Cl 0,5 M! (Kb NH4OH = 1,8 x 10-5)
A. 9 – log 7,2
B. 8 + log 7,2
C. 9 + log 7,2
D. 8 – log 7,2
E. 10 – log 7,2
JAWABAN BENAR
C.
9 + log 7,2
PEMBAHASAN
mol NH3 = 400 x 0,5 = 200 mmol
mol NH4Cl = 100 x 0,5 = 50 mmol
[OH–] = Kb x (mol basa/mol garam)
[OH–] = 1,8 x 10-5 x (200/50)
[OH–] = 7,2 x 10-5
pOH = - log[OH-]
pOH = - log[7,2 x 10-5]
pOH = 5 - log 7,2
pH = 14 - (5 - log 7,2)
pH = 9 + log 7,2
5.
Cermati soal berikut!
100 mL larutan HF 0,2 M (Ka = 10-5) dicampur dengan 800 mL larutan NaF 0,25 M. Berapakah pHnya ?
A. 6
B. 7
C. 8
D. 9
E. 10
JAWABAN BENAR
A.
6
PEMBAHASAN
mol HF = 100 x 0,2 = 20 mmol
mol NaF = 800 x 0,25 = 200 mmol
[H+] = Ka x (mol asam/mol garam)
[H+] = 10-5 x (20/200)
[H+] = 1 x 10-6
pH = - log[H+] = 6
6.
Kerjakan dengan cermat!
Larutan penyangga banyak digunakan dalam analisis kimia, biokimia, dan mikrobiologi. Selain itu, ia juga bermanfaat dalam berbagai bidang industri seperti... (kecuali)
A. Fotografi
B. Sintesis zat warna
C. Penyepuhan
D. Sintesis obat-obatan
E. Memasak
JAWABAN BENAR
E.
Memasak
PEMBAHASAN
dalam bidang industri, larutan penyangga banyak digunakan pada proses seperti fotografi, electroplating (penyepuhan), pembuatan bir, penyamakan kulit, sintesis zat warna, sintesis obat-obatan, maupun penanganan limbah.
7.
Kerjakan dengan teliti
Larutan penyangga juga bermanfaat dalam tubuh manusia seperti ...
A. pH darah
B. bakso
C. urine
D. jantung
E. paru-paru
JAWABAN BENAR
A.
pH darah
PEMBAHASAN
Di dalam tubuh makhluk hidup terdapat larutan penyangga yang sangat berperan penting. Dalam keadaan normal, pH darah manusia yaitu 7,4. pH darah tidak boleh turun di bawah 7,0 ataupun naik diatas 7,8 karena akan berakibat fatal bagi tubuh. pH darah dipertahankan pada 7,4 oleh larutan penyangga karbonat-bikarbonat (H2CO3 atau HCO3-) dengan menjaga perbandingan konsentrasi antara H2CO3 dan HCO3- sama dengan 1 banding 20.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


