Materi Kimia - Hukum Dasar Kimia, Konsep Mol, dan Stoikiometri Kelas 11 - Belajar Pintar
BelajarPintarV3
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab keenam.
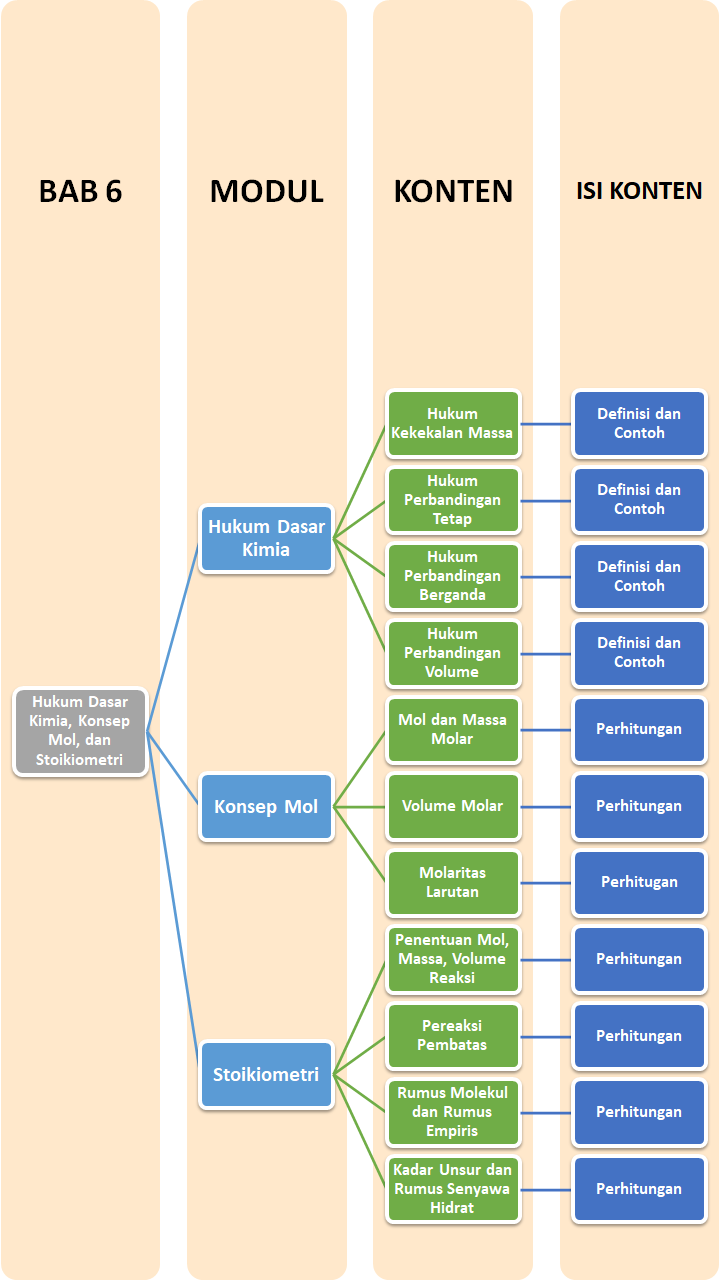
Yuk, mulai belajar bersama!
Hukum Kekekalan Massa (Hukum Lavoisier)


Hukum Lavoisier menyatakan kekekalan massa pada reaksi.
"Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi adalah tetap."
Dalam hal ini, berarti suatu zat yang mengalami reaksi kimia tidak berubah massa. Oleh karena itu, reaktan memiliki massa yang sama dengan produk yang dihasilkannya. Pada reaksi kimia, terjadi perubahan warna, suhu, pembentukan gas dan endapan.
Contoh:
jika kita mereaksikan hidrogen 4 gram dan oksigen 32 gram, menghasilkan hidrogen oksida 36 gram (14 + 32 = 36).
Mol dan Massa molar

Mol merupakan satuan yang menunjukkan ukuran jumlah partikel yang ada dalam suatu zat apapun.
Nilai mol dinotasikan dengan L yang disebut sebagai tetapan Avogadro.
L = 6,02 x 1023 partikel/atom/molekul
Jumlah partikel benda dapat dicari menggunakan konsep mol, dapat dirumuskan:

Massa molar (mm) adalah massa penyusun suatu atom/senyawa benda.
Massa molar dapat ditentukan dengan menjumlahkan Ar penyusun atom atau Mr pada senyawa benda.
Contoh:
CO2 memiliki Mr 44 gr/mol, karena Ar C = 12 gr/mol, dan Ar O = 16 gr/mol.
Dengan menggunakan massa molar dan konsep mol, kita dapat mencari massa nyata suatu atom/senyawa, dapat dirumuskan:
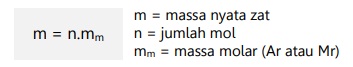
Penentuan Mol, Massa, dan Volume Zat dalam Reaksi

Prinsip stoikiometri reaksi umum untuk menemukan mol, massa dan volume zat yang direaksikan dan dihasilkan:
- Perbandingan koefisien adalah perbandingan jumlah mol zat dalam reaksi.
- Segala satuan ukuran zat harus dikonversikan ke dalam mol.
Contoh:
KO2 direaksikan dengan 132 gram CO2, menurut reaksi:
4KO2(s) + 2CO2(g) --> 2K2CO3(s) + 3O2(g)
(Ar K = 39, O = 16, C = 12)
Tentukan:
- Jumlah mol gas karbondioksida
- Massa kalium superoksida yang direaksikan
- Massa kalium karbonat yang dihasilkan
- Jumlah liter gas yang dihasilkan jika reaksi terjadi pada suhu 27oC dan tekanan 3 atm
Jawab:
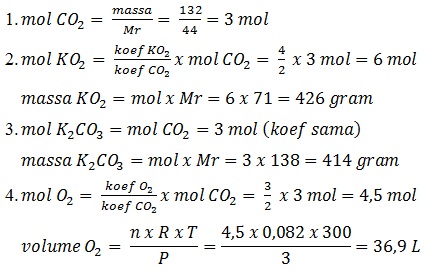
Suatu sampel atau cuplikan unsur dapat diketahui mol dan massa zat murninya bila direaksikan.
Contoh:
Suatu 36 gram cuplikan logam magnesium dengan kemurnian 90% dimasukkan ke dalam larutan asam nitrat 2 M menurut reaksi:
3Mg(s) + 8HNO3(aq) --> 3Mg(NO3)2(aq) + 4H2O(l) + 2NO(g)
(Ar Mg = 24, H = 1, N = 14, O = 16)
Tentukan:
- Mol Mg murni
- Massa Mg murni
- Volume larutan HNO3 yang dibutuhkan
- Volume NO yang dihasilkan pada (p,t) dimana massa 1,2 L gas N2 adalah 1,4 gr
Jawab:
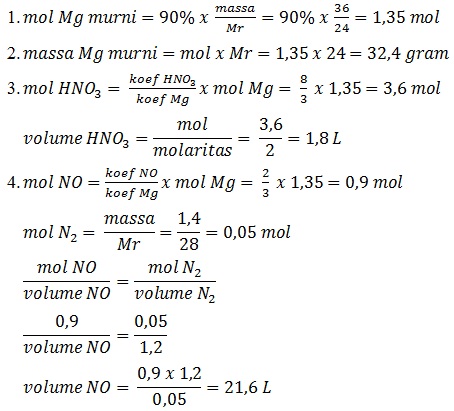
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved