Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Hukum Termokimia
MATERI
Entalpi dan Perubahan Entalpi

Setiap zat kimia memiliki energi. Energi ini tersimpan dalam bentuk energi potensial dan dikenal sebagai energi kimia. Besarnya energi yang dimiliki suatu zat disebut dengan entalpi dan dinotasikan dengan H (Heat Content). Harga entalpi suatu zat/sistem tidak dapat ditentukan, yang dapat ditentukan adalah perubahan entalpi yang menyertai suatu proses (proses kimia atau fisika).
Perubahan entalpi adalah selisih antara entalpi akhir (produk) dengan entalpi awal (pereaksi).
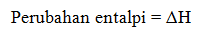
Untuk reaksi :
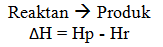
Dengan keterangan:
Hp = entalpi produk
Hr = entalpi reaktan
Apabila reaksi berlangsung pada tekanan tetap dan jenis kerja yang menyertainya hanya kerja ekspansi, maka perubahan entalpi sama dengan jumlah kalor yang diserap atau dibebaskan.
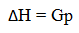
(Gp = kalor reaksi pada tekanan tetap). Jadi, perubahan entalpi adalah besarnya energi (kalor/panas) yang dibebaskan atau diperlukan dari suatu reaksi kimia.
Reaksi Eksoterm dan Endoterm

Reaksi Eksoterm dan Endoterm
Berdasarkan perubahan entalpinya, reaksi kimia dibedakan menjadi dua, yaitu reaksi eksoterm dan endoterm.
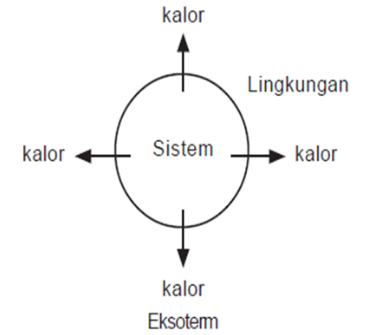
Reaksi eksoterm : kalor mengalir dari sistem ke lingkungan
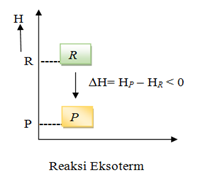
Pada reaksi eksoterm, sistem melepas energi. Oleh karena itu, entalpi akan berkurang, artinya entalpi produk (Hr) lebih kecil daripada entalpi pereaksi (Hr). Akibatnya, perubahan entalpi, yaitu selisih antara entalpi produk dengan entalpi pereaksi (Hp–Hr) bertanda negatif
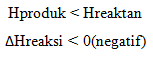
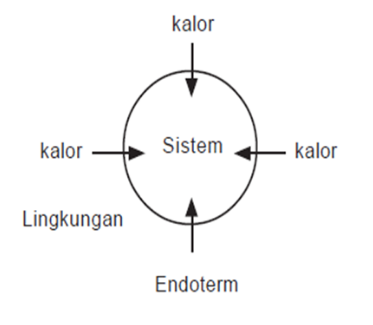
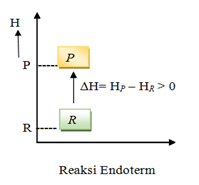
Reaksi endoterm : kalor mengalir dari lingkungan ke sistem
Pada reaksi endoterm, sistem menyerap energi. Oleh karena itu, entalpi akan bertambah, artinya entalpi produk (Hp) lebih besar daripada entalpi pereaksi (Hr). Akibatnya, perubahan entalpi, yaitu selisih antara entalpi produk dengan entalpi pereaksi (Hp–Hr) bertanda positif.
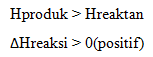
Perubahan entalpi pada reaksi eksoterm dan endoterm dapat dinyatakan dengan diagram tingkat energi, seperti berikut :
Persamaan Termokimia

Persamaan termokimia adalah persamaan reaksi yang mengikutsertakan perubahan entalpinya. Nilai perubahan entalpi yang dituliskan pada persamaan termokimia disesuaikan dengan stoikiometri reaksi, artinya jumlah mol zat yang terlibat dalam reaksi sama dengan koefisien reaksinya. Selanjutnya wujud atau keadaan zat harus dinyatakan, yaitu dengan membubuhkan indeks (s) untuk zat padat, (l) untuk zat cair, (g) untuk zat gas, dan (aq) untuk larutan.
Contoh:
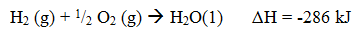
Atau
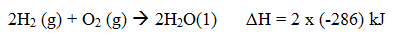
Persamaan termokimia meliput reaktan, produk, fasa, dan perubahan entalpi.
Hal-hal yang perlu diperhatikan dalam menuliskan persamaan termokimia adalah:
- Koefisien reaksi sudah menyatakan mol
- Kalau persamaan reaksi dibalik, kamu tinggal membalik nilai dari (+) menjadi (-), atau sebaliknya
- Kalau persamaan reaksi dikalikan, perubahan entalpinya juga harus kamu kalikan dengan x.
- Kalau persamaan reaksi dijumlahkan, kamu harus menjumlahkan perubahan entalpinya juga.
1.
Jawablah soal berikut ini!
Persamaan reaksi yang mengikutsertakan perubahan entalpinya adalah...
A. Persamaan Termokimia
B. Termokimia
C. Entalpi
D. Energi Kimia
E. Kalor
JAWABAN BENAR
A.
Persamaan Termokimia
PEMBAHASAN
Persamaan termokimia adalah persamaan reaksi yang mengikutsertakan perubahan entalpinya.
2.
Jawablah soal berikut ini!
Jumlah energi dari semua bentuk energi yang dimiliki oleh suatu zat atau sistem yang terdiri atas energi dalam dan kerja disebut...
A. Termokimia
B. Sistem dan Lingkungan
C. Reaksi Eksoterm dan Endoterm
D. Entalpi
E. Kalor Jenis
JAWABAN BENAR
D.
Entalpi
PEMBAHASAN
Entalpi merupakan jumlah energi dari semua bentuk energi yang dimiliki oleh suatu zat atau sistem yang terdiri atas energi dalam dan kerja.
3.
Jawablah soal berikut ini!
Berikut adalah hal yang perlu diperhatikan dalam menuliskan persamaan termokimia, kecuali....
A. koefisien reaksi sudah menyatakan mol
B. jika persamaan reaksi dibalik, maka nilai entalpi juga dibalik
C. pengaruh konsentrasi juga berpengaruh dalam entalpi
D. jika persamaan reaksi dikalikan, maka nilai entalpi juga dikalikan
E. jika persamaan reaksi dijumlahkan, maka nilai entalpi jika dijumlahkan
JAWABAN BENAR
C.
pengaruh konsentrasi juga berpengaruh dalam entalpi
PEMBAHASAN
Hal yang perlu diperhatikan dalam menuliskan persamaan termokimia adalah:
- Koefisien reaksi sudah menyatakan mol
- Jika persamaan reaksi dibalik, maka nilai entalpi juga dibalik
- Jika persamaan reaksi dikalikan, maka nilai entalpi juga dikalikan
- Jika persamaan reaksi dijumlahkan, maka nilai entalpi jika dijumlahkan
4.
Jawablah soal berikut ini!
Suatu reaksi kimia digambarkan dengan diagram reaksi berikut.
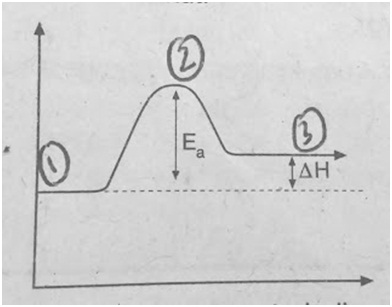
Reaksi kimia yang terjadi merupakan reaksi....
A. eksoterm, karena = -
B. eksoterm, karena = +
C. eksoterm, karena = 0
D. endoterm, karena = -
E. endoterm, karena = +
JAWABAN BENAR
E.
endoterm, karena = +
PEMBAHASAN
Berikut ini keterangan nomor pada gambar:
- keadaan awal reaksi (reaktan) entalpi reaktan
- energi aktivasi yaitu energi minimum yang dibutuhkan oleh dua zat yang dapat bereaksi.
- keadaan akhir reaksi (produk) entalpi produk
Dari gambar terlihat bahwa entalpi reaktan entalpi produk
sehingga :

5.
Jawablah soal berikut ini!
Salah satu ciri reaksi eksoterm adalah....
A. terjadi penurunan suhu
B. perubahan entalpi positif
C. reaksi memerlukan kalor
D. berlangsung tidak spontan
E. terjadi perpindahan kalor dari sistem ke lingkungan
JAWABAN BENAR
E.
terjadi perpindahan kalor dari sistem ke lingkungan
PEMBAHASAN
Ciri - ciri reaksi eksoterm
- Adanya peningkatan suhu
- Entalpi produk lebih kecil dibandingkan dengan entalpi reaktan sehingga harga delta H = -
- Reaksi berlangsung spontan (karena tidak menyerap energi, melainkan melepaskan energi/kalor dari sistem ke lingkungan)
6.
Jawablah soal berikut ini!
Yang dimaksud dengan perubahan entalpi yaitu….
A. Perubahan suhu
B. Perubahan keadaan
C. Perubahan hari
D. Perubahan kalor
E. Perubahan suasana
JAWABAN BENAR
D.
Perubahan kalor
PEMBAHASAN
Perubahan entalpi adalah perubahan kalor yang diukur pada tekanan konstan, untuk menentukan perubahan entalpi dilakukan dengan cara yang sama dengan penentuan perubahan kalor yang dilakukan pada tekanan konstan.
Kalor energi yang terjadi akibat adanya perbedaan suhu. Jadi, perubahan kalor pada suatu reaksi dapat diukur melalui pengukuran perubahan suhu yang terjadi.
7.
Jawablah soal berikut ini!
Sebuah Kristal KNO3 dimasukkan ke dalam tabung reaksi kemudian ditetesi dengan air. Pada tabung reaksi terasa dingin. Reaksi ini dapat digolongkan….
A. Eksoterm, energi berpindah dari sistem ke lingkungan
B. Eksoterm, energi berpindah dari lingkungan ke sistem
C. Endoterm, energi berpindah dari sistem ke lingkungan
D. Endoterm, energi berpindah dari lingkungan ke sistem
E. Endoterm, energi tidak berpindah
JAWABAN BENAR
D.
Endoterm, energi berpindah dari lingkungan ke sistem
PEMBAHASAN
Pada percobaan tersebut dikatakan endoterm, karena pada saat KNO3 bereaksi dengan air, temperaturnya turun karena tabung reaksi terasa dingin. Setelah sampai pada titik terendah, lama-kelamaan temperatur akan naik kembali sampai temperatur awal.
Penurunan temperatur pada saat KNO3 bereaksi dengan air, menunjukkan bahwa reaksi menyerap kalor. Pada reaksi endoterm reaksi yang menyerap kalornya berpindah dari lingkungan ke sistem, sehingga kalor dari sistem akan bertambah. Sehingga lingkungannya terasa dingin atau pada soal lingkungannya tabung reaksi.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

