Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Fisika
Termodinamika
MATERI
Pengertian Gas Ideal

Gas sejati adalah gas nyata yang ada di sekitar kita. Contohnya yakni gas yang kita hirup, gas yang keluar dari kendaraan bermotor, dan sebagainya. Gas sejati memiliki sifat dan interaksi yang sangat kompleks.
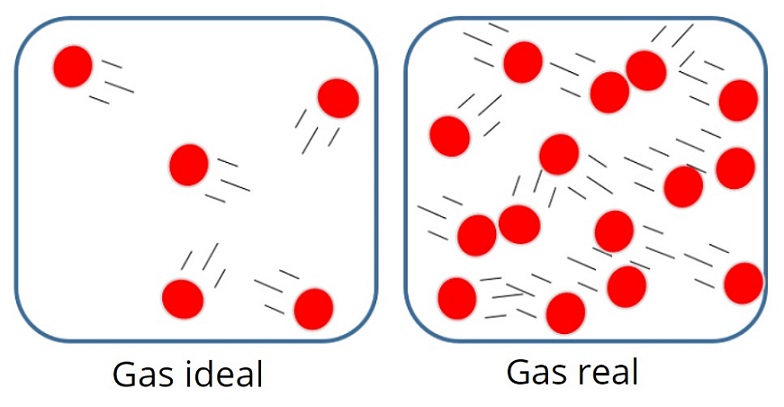
Sementara itu, gas ideal adalah gas teoretik yang digunakan untuk mempelajari perilaku gas. Karena gas sejati bersifat kompleks, maka susah bagi kita untuk mempelajari perilakunya, Oleh karena itu, gas sejati ini disederhanakan menjadi gas ideal. Karena telah disederhanakan, gas ideal pun memiliki sifat dan interaksi yang lebih sederhana dibandingkan gas sejati. Jadi, sederhananya, gas ideal ini adalah model untuk perhitungan perilaku gas sejati atau gas nyata.
Adapun sifat-sifat gas ideal adalah sebagai berikut, sobat :
- Partikelnya berjumlah banyak.
- Tidak ada interaksi antarpartikel atau tidak ada gaya tarik menarik antarpartikelnya.
- Jika dibandingkan ukuran ruangan, ukuran partikel gas ideal bisa diabaikan.
- Tumbukan yang terjadi antara partikel gas dan dinding ruangan merupakan tumbukan lenting sempurna.
- Partikel gas tersebar secara merata di dalam ruangan.
- Partikel gas bergerak secara acak ke segala arah.
- Berlaku Hukum Newton tentang gerak.
- Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu mutlaknya.
Hukum Hukum dalam Gas Ideal

- Hukum Boyle
Hukum Boyle menjelaskan hubungan antara tekanan dan volume gas pada suhu konstan.
Diasumsikan dalam silinder memiliki volume V1 dan tekanan P1. Jika piston ditekan hingga volume gas menjadi 1/2 V1 pada suhu konstan, tekanan gas akan bertambah menjadi 2P1. Jika piston ditekan hingga volume gas menjadi 1/4 V1 pada suhu konstan, tekanan gas akan bertambah menjadi 4P1. Penjelasan tersebut dapat dinyatakan dalam persamaan berikut:
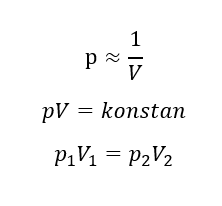
Persamaan tersebut pertama kali dinyatakan oleh Robert Boyle pada tahun 1666 dan dinamakan hukum Boyle. Bunyi hukum Boyle yaitu, “pada sistem tertutup dan bersuhu konstan (isotermik), besar tekanan gas berbanding terbalik dengan besar volumenya”
- Hukum Charles
Hukum Charles membahas hubungan antara volume dan suhu pada ruang tertutup. “Apabila tekanan gas yang berada di dalam suatu ruangan tertutup bersifat konstan, maka suhu mutlaknya akan berbanding lurus dengan volume gas tersebut.”. Anggap suhu dan volume mula-mula T1 dan V1 . Saat suhu dinaikkan menjadi 2T1 , volume gas menjadi 2V1 . Saat suhu dinaikkan menjadi 4T1, volume gas menjadi 4V1 . Penjabarannya dapat dituliskan dengan persamaan berikut.
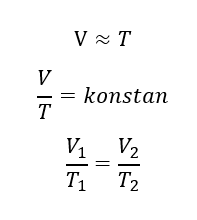
- Hukum Gay-Lussac
Hukum Gay-Lussac menjelaskan hubungan antara suhu dan tekanan gas pada volume konstan (isokhorik). Joseph Gay-Lussac menyimpulkan pada sistem dengan volume gas konstan, besarnya suhu mutlak gas sebanding dengan tekanannya. Pernyataan tersebut ditulis dalam persamaan berikut:
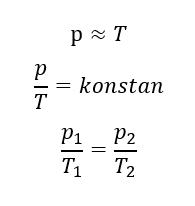
Persamaan Umum Gas Ideal

Setelah kita mempelajari materi sebelumnya tentang hukum Boyle, hukum Charles, dan hukum Gay-Lussac. Jika ketiga hukum disatukan, dikenal dengan persamaan umum gas ideal. Persamaannya dituliskan sebagai berikut.
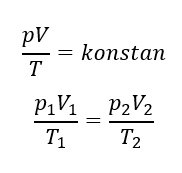
Persamaan gas ideal berlaku untuk gas dalam bejana tertutup dan diasumsikan tidak ada kebocoran sehingga massa gas tetap. Apabila sejumlah mol (n) gas diubah, persamaannya dituliskan sebagai berikut.
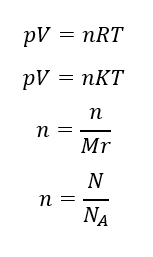
1.
Kerjakan soal berikut ini dengan tepat!
Sejumlah gas ideal pada mulanya mempunyai tekanan P dan volume V. Jika gas tersebut mengalami proses isotermal sehingga tekanannya menjadi 4 kali tekanan semula maka volume gas berubah menjadi…
A. 1/5 v
B. 1/4 v
C. 1/3 v
D. 1/2 v
E. 1 v
JAWABAN BENAR
B.
1/4 v
PEMBAHASAN
Diketahui :
Tekanan awal (P1) = P
Tekanan akhir (P2) = 4P
Volume awal (V1) = V
Ditanya : volume akhir gas (V2)
Jawab :
Hukum Boyle (proses isotermal atau suhu konstan) :
P V = konstan
P1 V1 = P2 V2
(P)(V) = (4P)(V2)
V = 4 V2
V2 = V / 4 = 1/4 V
Volume gas berubah menjadi 1/4 kali volume awal
2.
Kerjakan soal berikut ini dengan tepat!
Dalam suatu wadah tertutup, gas memuai sehingga volumenya berubah menjadi 2 kali volume awal (V = volume awal, P = tekanan awal). Tekanan gas berubah menjadi…
A. 1/6 P
B. 1/5 P
C. 1/4 P
D. 1/3 P
E. 1/2 P
JAWABAN BENAR
E.
1/2 P
PEMBAHASAN
Diketahui :
Tekanan awal (P1) = P
Volume awal (V1) = V
Volume akhir (V2) = 2V
Ditanya : tekanan akhir (P2)
Jawab :
P1 V1 = P2 V2
P V = P2 (2V)
P = P2 (2)
P2 = P / 2 = 1/2 P
Tekanan gas berubah menjadi 1/2 kali tekanan awal.
3.
Kerjakan soal berikut ini dengan tepat!
Gas ideal menempati ruangan dengan volume tetap Jika suhu dinaikkan menjadi 1,5 kali semula perbandingan tekanan awal dan tekanan akhir gas adalah….
A. 1 : 2
B. 2 : 1
C. 2 : 3
D. 3 : 4
E. 3 : 2
JAWABAN BENAR
C.
2 : 3
PEMBAHASAN
Proses isokorik
T2 = 1,5 T1
P1 : P2 = __?
Pada proses isokorik berlaku
P1 / T1 = P2 / T2
P1 / P2 = T1 / T2
P1 / P2 = T1 / (1,5 T1)
P1 / P2 = 2/3
P1 : P2 = 2 : 3
4.
Kerjakan soal berikut ini dengan tepat!
- Berlaku Hukum Newton
- Kelajuan dan gerak partikel tetap
- Selang waktu tumbukan sangat singkat
- Semua tumbukan partikel bersifat lenting tidak sempurna
Syarat suatu gas dikatakan ideal ditunjukan oleh nomor ….
A. 1) dan 2)
B. 1) dan 3)
C. 2) dan 3)
D. 2) dan 4)
E. 3) dan 4)
JAWABAN BENAR
B.
1) dan 3)
PEMBAHASAN
Sifat-sifat gas ideal adalah sebagai berikut.
- Partikelnya berjumlah banyak.
- Tidak ada interaksi antarpartikel atau tidak ada gaya tarik menarik antarpartikelnya.
- Jika dibandingkan ukuran ruangan, ukuran partikel gas ideal bisa diabaikan.
- Tumbukan yang terjadi antara partikel gas dan dinding ruangan merupakan tumbukan lenting sempurna.
- Partikel gas tersebar secara merata di dalam ruangan.
- Partikel gas bergerak secara acak ke segala arah.
- Berlaku Hukum Newton tentang gerak.
- Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu mutlaknya.
5.
Kerjakan soal berikut ini dengan tepat!
Berikut ini merupakan contoh penerapan yang melibatkan hukum hukum gas ideal kecuali…
A. Ban meletus dibawah teriknya matahari
B. Gelembung pada minuman bersoda
C. Rel kereta yang memuai
D. Jarum suntik
E. Cat semprot
JAWABAN BENAR
C.
Rel kereta yang memuai
PEMBAHASAN
Ban meletus dibawah teriknya matahari, Gelembung pada minuman bersoda, Jarum suntik dan Cat semprot merupakan beberapa contoh penerapan yang didalamnya memuat hukum hukum gas ideal. Karena terdapat variabel variabel seperti suhu, tekanan, dan volume. Sedangkan rel kereta yang memuai merupakan contoh pemuaian pada benda, bukan gas ideal.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

