Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Ikatan Kimia
MATERI
Teori VSEPR

Bentuk molekul berhubungan dengan posisi atom-atom dalam suatu molekul. Bentuk molekul menggambarkan posisi atom-atom dalam ruang tiga dimensi dan besarnya sudut ikatan yang terjadi dalam ikatan kovalen dalam suatu molekul.
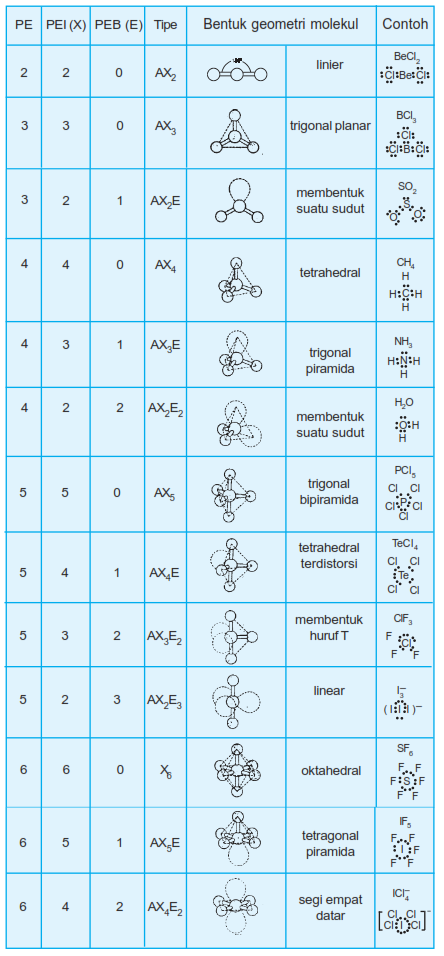
Teori VSEPR (Valence Shell Electron Pair Repulsion) adalah suatu cara untuk meramalkan geometri molekul berdasarkan tolak menolak elektron pada kulit luar atom pusat. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron. Teori ini didasarkan pada gagasan pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB) di sekitar atom pusat dan akan mengatur posisinya sebisa mungkin saling menjauh satu sama lain.
Meramalkan Bentuk Molekul berdasarkan Teori VSEPR
Langkah-langkah dalam penentuannya sebagai berikut:
- Membuat konfigurasi elektron
- Menentukan elektron valensi
- Membuat struktur Lewis
- Menentukan PEI dan PEB pada atom pusat
- Menentukan bentuk molekulnya
Rumus pasangan elektron dalam suatu molekul disimbolkan sebagai berikut:
AXnEm
Keterangan :
A = atom pusat
X = pasangan elektron ikatan
E = pasangan elektron bebas
n = jumlah pasangan elektron ikatan
m = jumlah pasangan elektron bebas
Berikut tabel geometri bentuk molekul:
Konsep Hibridisasi

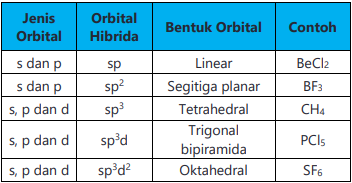
Konsep hibridisasi digunakan untuk menjelaskan bentuk geometri molekul. Bentuk molekul itu sendiri ditentukan melalui percobaan atau mungkin diramalkan berdasarkan teori tolakan elektron.
Hibridisasi merupakan konsep menyatunya orbital atom sehingga membentuk orbital hibrid baru yang sesuai pada penjelasan kualitatif sifat ikatan atom. Secara sederhana hibridisasi merupakan pembentukan orbital karena gabungan (peleburan) dari dua atau lebih orbital atom dalam satuan atom.
Contoh:
Perhatikan gambar molekul CH4 berikut
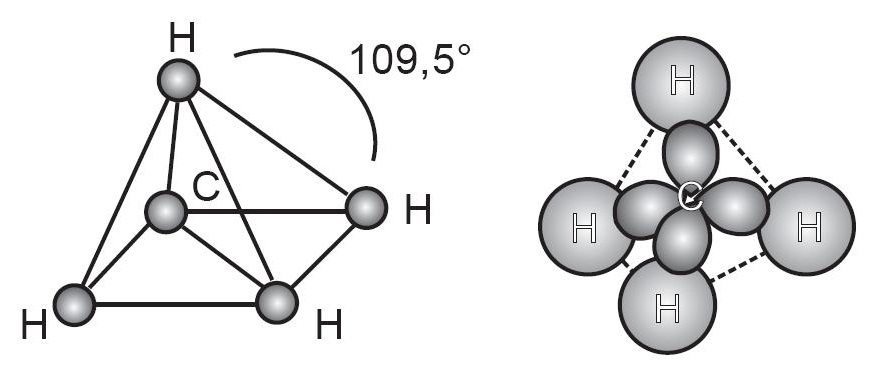
Molekul metana (CH4) mempunyai struktur tetrahedral yang simetris. Masing-masing ikatan karbon hidrogen mempunyai jarak yang sama yaitu 1,1 angstrom dan sudut antara setiap pasang elektron adalah 109,50.
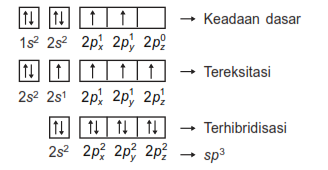
Karbon mempunyai nomor atom 6 sehingga konfigurasi elektronnya: 1s2 2s2 2p2
Sedangkan hidrogen mempunyai nomor atom 1 sehingga konfigurasi elektronnya: 1s1
Hibridisasi atom C dengan H pada CH4 adalah sebagai berikut:
Bentuk-bentuk molekul berdasarkan teori hibridisas
1.
Kerjakan soal berikut ini dengan tepat!
Bentuk molekul dari tipe molekul AX4E adalah....
A. Tetrahedral
B. Tetrahedral terdistorsi
C. Linear
D. Bentuk V
E. Segitiga planar
JAWABAN BENAR
B.
Tetrahedral terdistorsi
PEMBAHASAN
AX4E artinya molekul tersebut mempunyai 4 pasangan elektron berikatan dan 1 pasang elektron bebas. bentuk molekulnya adalah Tetrahedral terdistorsi.
2.
Kerjakan soal berikut ini dengan tepat!
Suatu senyawa memiliki orbital hibrida sp3, maka bentuk orbitalnya adalah....
A. Tetrahedral
B. Linear
C. Segitiga planar
D. Trigonal bipiramida
E. Oktahedral
JAWABAN BENAR
A.
Tetrahedral
PEMBAHASAN
Orbital hibrida sp3 mekanismenya digambarkan sebagai berikut:
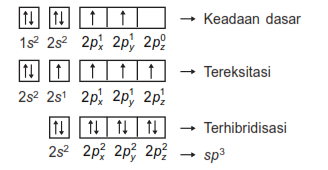
Contoh senyawanya adalah CH4 dan bentuk orbitalnya adalah Tetrahedral.
3.
Kerjakan soal berikut ini dengan tepat!
Diketahui unsur 5A berikatan dengan unsur 9Q. Jika A dan Q membentuk senyawa AQ3, maka apakah bentuk dari molekul ini ?
A. Segitiga planar
B. Tetrahedral
C. Bentuk T
D. Bentuk V
E. Trigonal piramida
JAWABAN BENAR
A.
Segitiga planar
PEMBAHASAN
Unsur A konfigurasinya: 2, 3
Unsur Q konfigurasinya: 2, 7
Jumlah ev atom unsur pusat A = 3
Jumlah pasangan elektron Ikatan (X) = 3
Jumlah pasangan elektron Bebas (E) = 0
Tipe molekul AX3 yaitu Segitiga Planar
4.
Kerjakan soal berikut ini dengan tepat!
Diketahui unsur 6B berikatan dengan unsur 1T. Jika B dan T membentuk senyawa BT4, maka apakah bentuk dari molekul ini ?
A. Segitiga planar
B. Tetrahedral
C. Bentuk T
D. Bentuk V
E. Oktahedral
JAWABAN BENAR
B.
Tetrahedral
PEMBAHASAN
Unsur B konfigurasinya: 2, 4
Unsur T konfigurasinya: 1
Jumlah ev atom unsur pusat B = 4
Jumlah pasangan elektron Ikatan (X) = 4
Jumlah pasangan elektron Bebas (E) = 0
Tipe molekul AX4 yaitu Tetrahedral
5.
Kerjakan soal berikut ini dengan tepat!
Diketahui unsur 7D berikatan dengan unsur 1S. Jika D dan S membentuk senyawa DS3, maka apakah bentuk dari molekul ini ?
A. Segitiga planar
B. Tetrahedral
C. Bentuk T
D. Segitiga piramida
E. Oktahedral
JAWABAN BENAR
D.
Segitiga piramida
PEMBAHASAN
Unsur D konfigurasinya: 2, 5
Unsur S konfigurasinya: 1
Jumlah ev atom unsur pusat D = 5
Jumlah pasangan elektron Ikatan (X) = 3
Jumlah pasangan elektron Bebas (E) = 1
Tipe molekul AX3E yaitu Trigonal Piramida/segitiga piramida/piramida trigonal.
6.
Kerjakan soal berikut ini dengan tepat!
Suatu unsur X dengan nomor atom 7 dan unsur Y dengan nomor atom 1 membentuk senyawa dengan ….
A. 3 PEI dan 1 PEB
B. 2 PEI dan 2 PEB
C. 2 PEI dan 1 PEB
D. 4 PEI dan 2 PEB
E. 1 PEI dan 3 PEB
JAWABAN BENAR
A.
3 PEI dan 1 PEB
PEMBAHASAN
Unsur X konfigurasinya: 2, 5
Unsur Y konfigurasinya: 1
Jumlah ev atom unsur pusat X = 5
Jumlah pasangan elektron Ikatan (X) = 3
Jumlah pasangan elektron Bebas (E) = 1
Tipe molekul AX3E
7.
Kerjakan soal berikut ini dengan tepat!
Unsur dengan notasi P memiliki konfigurasi elektron [Ne] 3s2 2p5 dan Q [Ar] 4s2 3d10 4p4 dapat membentuk molekul … hibridisasi …
A. PQ2 linier, sp
B. PQ2 bentuk V, sp3
C. QP2 linier, sp
D. QP2 bentuk V, sp3
E. P2Q5 trigonal bipiramida, sp3d2
JAWABAN BENAR
D.
QP2 bentuk V, sp3
PEMBAHASAN
Konfigurasi elektron
P = [Ne] 3s2 2p5
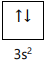
Q = [Ar] 4s2 3d10 4p4
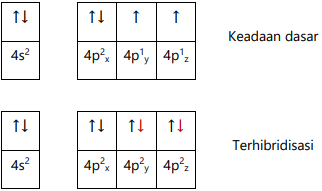
Jumlah ev atom unsur pusat Q = 4
Jumlah pasangan elektron Ikatan (X) = 2
Jumlah pasangan elektron Bebas (E) = 2
Hibridisasi sp3, tipe molekul AX2E2 memiliki geometri bentuk V

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

