Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Struktur Atom dan Sistem Periodik Unsur
MATERI
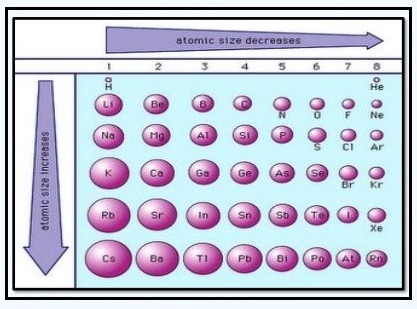
Jari-jari atom

Jari-jari atom adalah jarak yang dihitung dari inti atom hingga lintasan paling luar suatu atom. Dalam satu golongan, jari-jari atom meningkat dari atas ke bawah. Adapun dalam satu periode, jari-jari atom meningkat dari kanan ke kiri. Dalam satu periode, semakin ke kanan jumlah proton dan neutron semakin banyak sehingga gaya tarik inti terhadap elektron terluar semakin kuat sehingga jari-jari atom semakin kecil.
Sifat jari-jari atom dalam sistem periodik unsur digambarkan dalam gambar berikut:
Energi Ionisasi

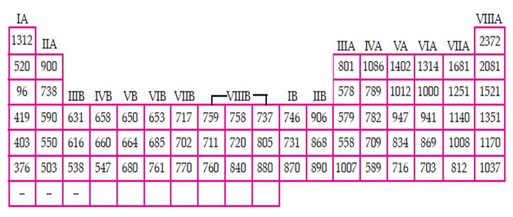
Energi ionisasi adalah energi yang diperlukan suatu atom untuk melepaskan satu elektron valensi membentuk ion positif. Dalam satu golongan, dari atas ke bawah jumlah kulit bertambah sehingga jarak elektron valensi ke inti atom bertambah dan elektron lebih mudah lepas. Akibatnya, energi ionisasi dalam satu golongan meningkat dari bawah ke atas.
Adapun dalam satu periode, semakin ke kanan jumlah proton dan neutron semakin banyak sehingga gaya tarik inti terhadap elektron terluar semakin kuat. Akibatnya diperlukan energi yang lebih besar untuk melepaskan elektron terluar. Dengan kata lain, dalam satu periode energi ionisasi meningkat dari kiri ke kanan.
Energi ionisasi dalam sistem periodik unsur digambarkan dalam gambar di bawah ini:
Afinitas Elektron

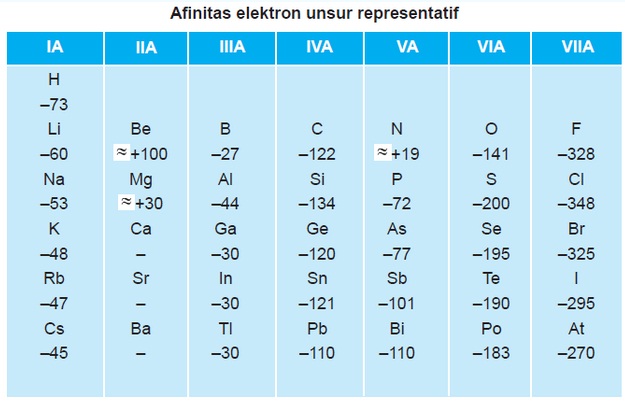
Afinitas elektron adalah besarnya energi yang dibebaskan satu atom netral dalam wujud gas pada waktu menerima satu elektron sehingga terbentuk ion negatif. Jika energi ionisasi selalu ditekankan pada pembentukan ion positif. Afinitas elektron ditekankan pada ion negatif, dan keduanya banyak dipakai untuk unsur-unsur pada golongan 6 dan 7 pada tabel periodik. Dalam satu golongan dari atas ke bawah, afinitas elektron semakin berkurang. Sedangkan dalam satu periode dari kiri ke kanan, afinitas elektron semakin bertambah.
Berbeda dengan energi ionisasi, afinitas elektron dapat berharga positif atau negatif. Jika satu elektron ditambahkan kepada atom yang stabil dan sejumlah energi diserap maka afinitas elektronnya berharga positif. Jika dilepaskan energi, afinitas elektronnya berharga negatif. Contohnya, ketika gas klor menerima elektron untuk membentuk ion negatif.
Untuk lebih jelasnya, Sobat Pintar bisa melihat gambar di bawah ini:
Keelektronegatifan

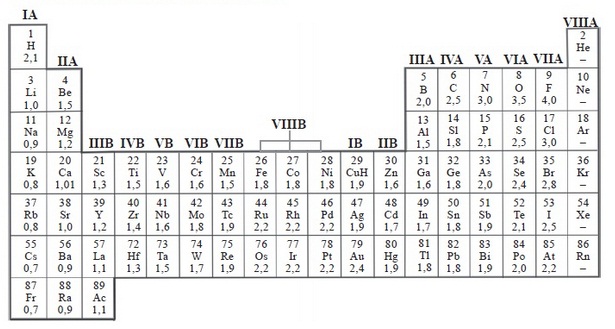
Keelektronegatifan adalah kecenderungan suatu unsur untuk menarik elektron sehingga bermuatan negatif. Dalam satu golongan dari atas ke bawah, keelektronegatifan semakin berkurang. Dalam satu periode dari kiri ke kanan keelektronegatifan semakin bertambah.
Konsep elektronegativitas pertama kali diperkenalkan oleh Linus Pauling pada tahun 1932 sebagai bagian dari perkembangan teori ikatan valensi. Elektronegativitas tidak bisa dihitung secara langsung, melainkan harus dikalkulasi dari sifat-sifat atom dan molekul lainnya. Beberapa metode kalkulasi telah diajukan. Walaupun pada setiap metode terdapat perbedaan yang kecil dalam nilai numeris elektronegativitasnya, semua metode memiliki tren periode yang sama di antara unsur-unsur.
Keelektronegatifan unsur dalam sistem periodik unsur dapat dilihat dalam gambar berikut:
1.
Kerjakan soal berikut ini dengan tepat!
Di bawah ini yang bukan merupakan sifat keperiodikan unsur adalah...
A. Jari-jari atom
B. Entalpi
C. Energi ionisasi
D. Afinitas elektron
E. Keelektronegatifan
JAWABAN BENAR
B.
Entalpi
PEMBAHASAN
Sifat keperiodikan unsur meliputi jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan
2.
Kerjakan soal berikut ini dengan tepat!
Dalam sistem periodik unsur, hal yang benar tentang jari-jari atom adalah...
A. semakin ke atas jari-jari atom semakin besar
B. semakin ke bawah jari-jari atom semakin kecil
C. semakin ke bawah jari-jari atom tetap
D. semakin ke atas jari-jari atom semakin menyusut
E. semakin ke bawah jari-jari atom semakin besar
JAWABAN BENAR
E.
semakin ke bawah jari-jari atom semakin besar
PEMBAHASAN
Dalam sistem periodik unsur, semakin ke bawah maka jari-jari atom akan semakin besar yang diakibatkan oleh jumlah kulit yang semakin banyak
3.
Kerjakan soal berikut ini dengan tepat!
Di antara sifat periodik unsur berikut, yang benar dalam satu golongan dari atas ke bawah adalah....
A. jari-jari atom semakin pendek
B. elektronegativitas semakin besar
C. energi ionisasi semakin besar
D. afinitas elektron semakin kecil
E. sifat logam semakin berkurang
JAWABAN BENAR
D.
afinitas elektron semakin kecil
PEMBAHASAN
Dalam satu golongan, dari atas ke bawah jari – jari atomnya semakin besar sehingga gaya tarik inti terhadap elektron terluar makin kecil. Akibatnya atom semakin sulit menarik elektron dari luar sehingga energi yang dibebaskan semakin sedikit (afinitas elektron makin kecil).
4.
Kerjakan soal berikut ini dengan tepat!
Di antara deret unsur halogen, atom yang memiliki keelektronegatifan paling besar adalah....
A. 9F
B. 17Cl
C. 35Br
D. 53I
E. 85At
JAWABAN BENAR
A.
9F
PEMBAHASAN
Dalam satu periode, dari bawah ke atas jari-jari atom semakin kecil sehingga gaya tarik inti terhadap elektron semakin besar. Akibatnya atom semakin mudah menarik elektron yang mengakibatkan harga keelektronegatifannya semakin besar. Unsur F unsur halogen yang paling atas.
5.
Jawablah soal berikut ini!
Diberikan data unsur sebagai berikut:
20Ca, 19K, 18Ar, 16S, 11Na
Dari kelima unsur tersebut, yang memiliki energi ionisasi paling besar adalah....
A. Na
B. S
C. Ar
D. K
E. Ca
JAWABAN BENAR
C.
Ar
PEMBAHASAN
Energi ionisasi dari kiri ke kanan semakin besar. Unsur Ar merupakan unsur gas mulia dimana posisinya paling kanan.
6.
Kerjakan soal berikut ini dengan tepat!
Pernyataan yang benar untuk atom 11Na dan 19K adalah …
A. Jari-jari atom K < Na
B. Energi ionisasi pertama Na < K
C. Jari-jari ion Na+ < K+
D. Keelektronegatifan Na < K
E. Afinitas elektron Na < K
JAWABAN BENAR
C.
Jari-jari ion Na+ < K+
PEMBAHASAN
11Na dan 19K berada pada 1 golongan. Sehingga,
Jari-jari atom Na < K
Jari-jari ion Na+ < K+
Energi ionisasi Na > K
Keelektronegatifan Na > K
Afinitas elektron Na > K
7.
Perhatikan pernyataan di bawah ini!
- Jari-jari atom A lebih besar dari jari-jari atom B.
- Atom A lebih sukar membentuk ion positif daripada atom B.
- A dan B terletak pada periode yang sama.
- Keelektronegatifan atom A lebih besar dari atom B.
Jika konfigurasi elektron A : 1s2 2s2 2p6 3s1 dan B : 1s2 2s2 2p6 3s2, maka penyataan yang benar adalah …
A. 1, 2, dan 3
B. 1 dan 3
C. 2 dan 4
D. 4 saja
E. 1, 2, 3, dan 4
JAWABAN BENAR
B.
1 dan 3
PEMBAHASAN
Berdasarkan konfigurasi elektron:
Unsur A adalah golongan IA dan unsur B adalah golongan IIA, sehingga, jari-jari atom A > jari-jari atom B.
Unsur A dan B terletak pada periode ke 3 (3s).

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

