Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Benzena dan Turunannya
MATERI
Struktur Kekule Benzena

Benzena adalah senyawa hidrokarbon aromatis yang bersifat tidak jenuh dengan rumus struktur C6H6
Struktur benzena pertama kali diperkenalkan oleh Friedrich August Kekule, kimiawan dari Jerman pada tahun 1865. Menurutnya, keenam atom karbon pada benzena tersusun secara melingkar membentuk segi enam beraturan dengan sudut ikatan masing-masing 120 derajat. Ikatan antara karbon adalah ikatan rangkap dua dan ikatan tunggal yang berselang seling (terkonjugasi). Benzena termasuk senyawa aromatik dan memiliki rumus molekul C6H6.
Friedrich Kekule (1829–1896) berhasil mengungkapkan bagaimana enam atom karbon pada molekul benzena berikatan dengan atom hidrogen. Dia menemukan pemecahannya ketika sedang tidur. Dia bermimpi tentang barisan atom-atom karbon dan hidrogen membentuk cincin, seperti seekor ular yang menelan ekornya sendiri.
Pada 1872, Kekule mengusulkan perubahan struktur benzena. Menurut Kekule, benzena mengandung tiga ikatan tunggal dan tiga ikatan rangkap yang posisinya berselang-seling.
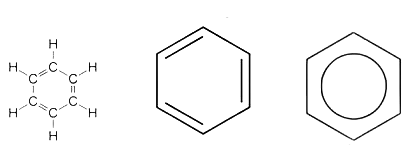
Berdasarkan hasil penelitian, diketahui bahwa setiap atom C pada cincin benzena memiliki sifat yang sama. Hal ini ditentukan setelah para ilmuwan mengetahui bahwa semua ikatan antaratom C memiliki panjang yang sama, yakni 140 pm (pikometer). Oleh karena semua atom C memiliki fungsi yang sama, ikatan rangkap senantiasa berubah-ubah.
Sifat-sifat Senyawa Benzena

Sifat Fisik:
- Zat cair tidak berwarna
- Memiliki bau yang khas
- Mudah menguap
- Larut dalam pelarut organik seperti CCl4, dietil eter, dan heksana
- Tidak larut dalam pelarut polar seperti air, tetapi larut dalam pelarut yang kurang polar atau nonpolar, seperti eter dan tetraklorometana
- Titik leleh: 5,5oC
- Titik didih: 80,1oC
- Densitas: 0,88
Sifat Kimia:
- Bersifat karsinogenik (racun)
- Merupakan senyawa nonpolar
- Tidak begitu reaktif, tapi mudah terbakar dengan menghasilkan banyak jelaga
- Lebih mudah mengalami reaksi substitusi daripada adisi
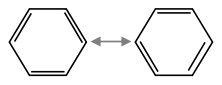
- Memiliki struktur Kekule (resonansi), dimana ikatan rangkap dapat berpindah
Turunan Benzena dan Tata Nama

Turunan Benzena
Turunan benzena atau derivat benzena diperoleh dari penggantian satu atom H atau lebih dari inti benzena dengan gugus-gugus lain.
Contoh:
Tata nama Benzena
Struktur cincin benzena dasar:
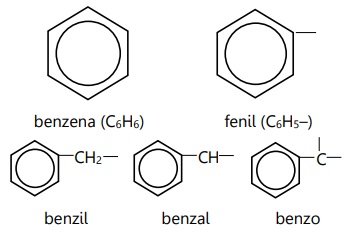
Substituen adalah cabang yang berikatan dengan cincin benzena.
Aturan penamaan IUPAC turunan benzena 1 substituen secara umum adalah cincin benzena merupakan rantai utama, sedangkan substituen dianggap sebagai cabang.
Apabila hanya satu atom H yang diganti dengan satu substituen unsur halogen, penamaannya dirumuskan sebagai berikut:
Penamaan IUPAC = substituen + benzena
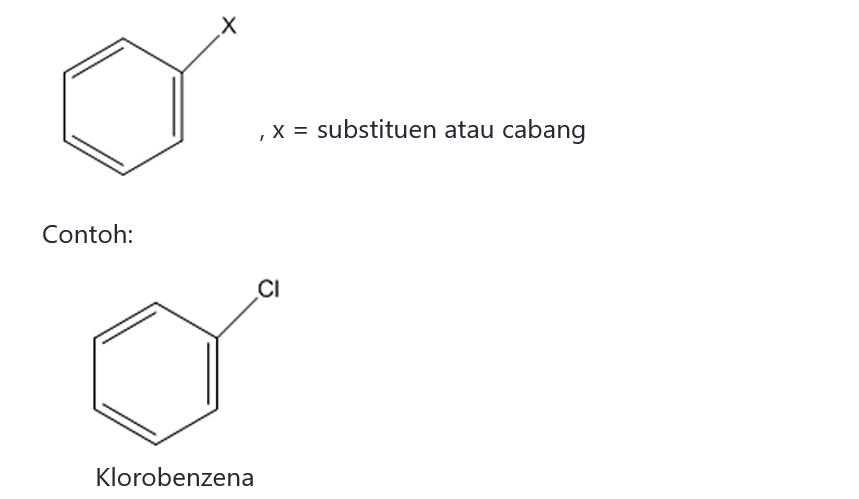
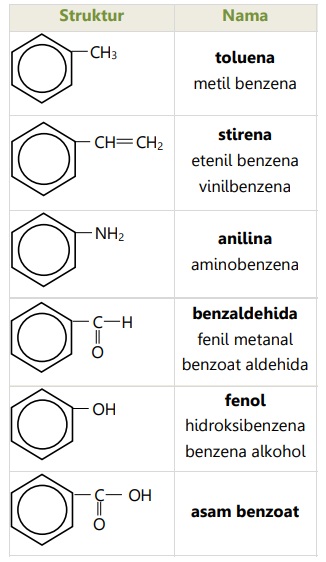
Beberapa senyawa turunan benzena 1 substituen mempunyai nama khusus yang lebih lazim digunakan:
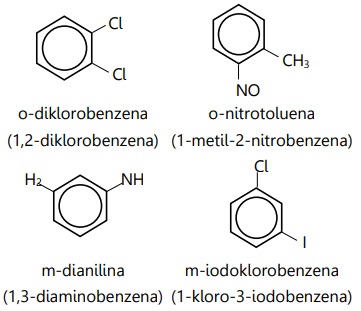
Aturan penamaan benzena 2 substituen:
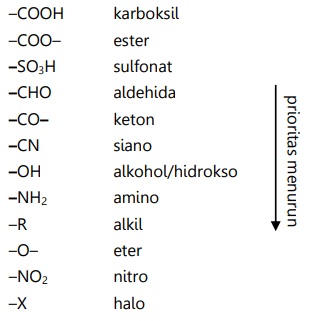
- Substituen prioritas menjadi rantai utama bersama cincin benzena.
- Substituen lain dianggap sebagai cabang. Jika kedua substituen sama, maka tidak ada substituen yang dianggap cabang.
- Posisi substituen dinyatakan dengan:
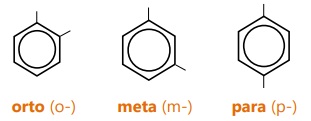
- Contoh benzena dengan 2 substituen:
Aturan penamaan benzena >2 substituen:
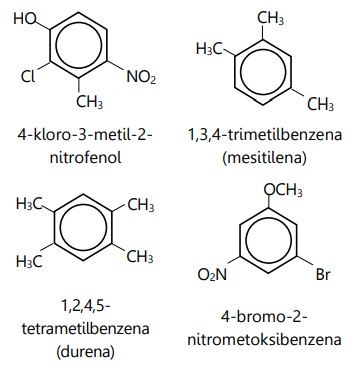
- Substituen prioritas menjadi rantai utama bersama cincin benzena.
- Substituen lain dianggap sebagai cabang.
- Posisi substituen dinyatakan dengan angka.
- Penomoran cabang dimulai dari atom karbon yang mengikat substituen prioritas tertinggi. Arah penomoran dilakukan ke substituen prioritas berikutnya.
Jika seluruh substituen sama, maka dianggap tidak ada cabang, namun posisi tetap ditulis. - Cabang sejenis yang jumlahnya >1 cukup ditulis sekali, namun diberi indeks.
- Jika terdapat lebih dari satu macam jenis cabang, maka urutan penamaan cabang diurut berdasarkan abjad dalam bahasa Inggris (sebelum diberi indeks).
- Contoh benzena dengan >2 substituen:
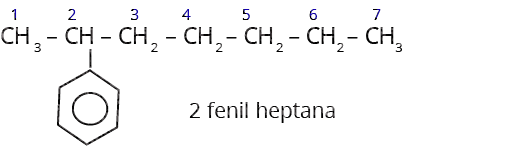
Aturan penamaan benzena terikat pada rantai karbon:
Apabila suatu cincin benzena terikat pada rantai alkana yang sangat panjang (>6), atau pada suatu rantai bergugus fungssi maka cincin benzena itu dianggap sebagai substituen, bukan sebagai induk dan dinamakan gugus fenil.
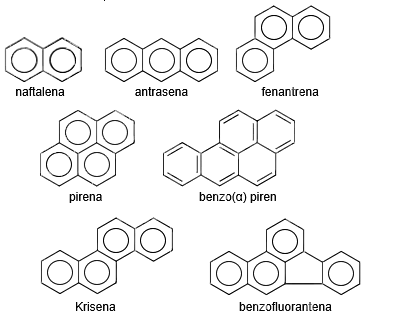
Penamaan benzena dari gabungan cincin benzena:
Reaksi-reaksi Benzena

Benzena memiliki cincin yang mengalami resonansi, sehingga sukar bereaksi dan diadisi.
Cincin benzena hanya dapat diserang atau direaksikan oleh pereaksi elektrofil (butuh elektron), misalnya asam, oksidator dan halogen.
Benzena lebih mudah mengalami reaksi substitusi dibanding adisi.
Reaksi-reaksi substitusi pertama pada benzena:
- Reaksi alkilasi Friedel-Crafts
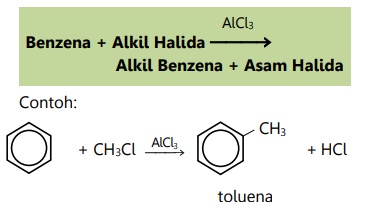
- Reaksi halogenasi
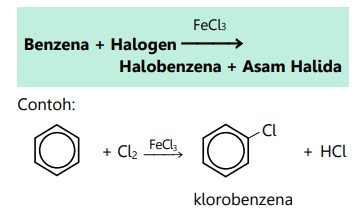
- Reaksi nitrasi
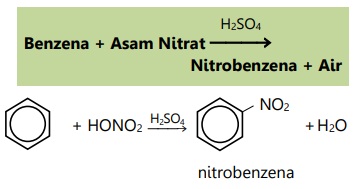
- Reaksi sulfonasi
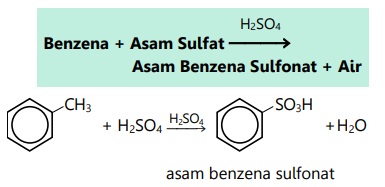
- Reaksi asilasi
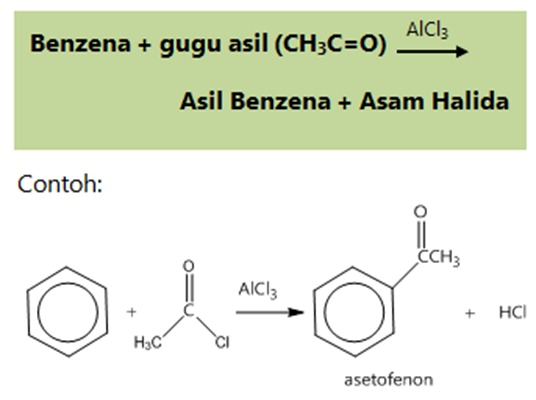
- Reaksi adisi
- Adisi hidrogen
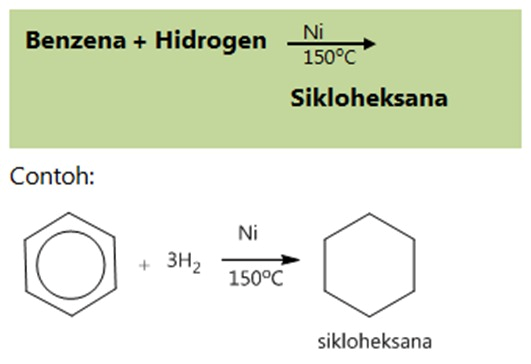
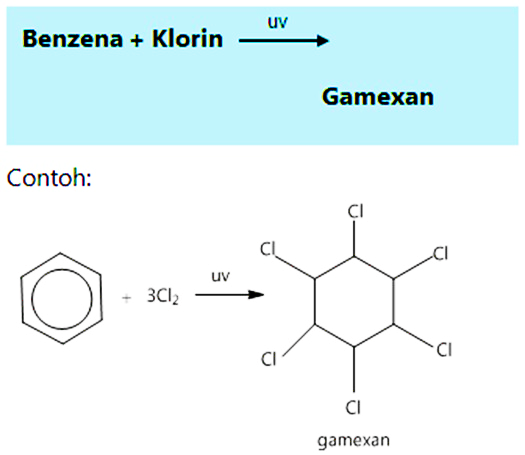
- Adisi klorin
Substituen pertama pada benzena mempengaruhi tempat substitusi kedua.
Kaidah substitusi kedua benzena:
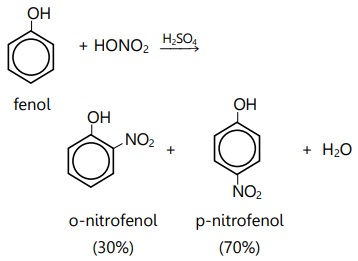
- Pengarah orto dan para
–OH, –O–, –NH2, –R, –X
Substituen pengarah orto dan para adalah substituen pemberi elektron atau yang memiliki pasangan elektron bebas.
Contoh:
- Pengarah meta
–NO2, –CN, –SO3H, –CHO, –CO–, –COOH, –COO–
Substituen pengarah meta adalah substituen penarik elektron atau yang tidak memiliki pasangan elektron bebas.
Contoh:
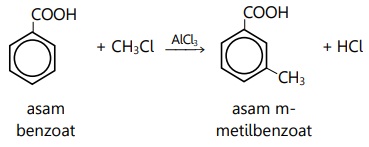
1.
Jawablah pertanyaan berikut dengan tepat!
Jika dibandingkan dengan ikatan C-C pada alkana dan ikatan C=C pada alkena, maka ikatan antara atom C pada benzena lebih ….
A. kecil dari C-C alkana, lebih besar dari C=C alkena
B. kecil dari ikatan C=C pada alkena
C. besar dari C-C pada alkana
D. besar dari keduanya
E. kecil dari keduanya
JAWABAN BENAR
A.
kecil dari C-C alkana, lebih besar dari C=C alkena
PEMBAHASAN
Benzena memiliki 3 buah ikatan rangkap selang-seling yang terkonjugasi, karena mengalami resonansi. Sebagai akibatnya, ketiga ikatan tunggal dan ketiga ikatan rangkap menyatu, sehingga panjang garis ikatannya sama.
Oleh sebab itulah struktur benzena digambar sebagai segi 6 sama sisi dengan lingkaran di tengah. Panjang garis ikatan ini menjadi lebih pendek dari C-C alkana dan lebih panjang dari C=C alkena.
2.
Jawablah pertanyaan berikut!
Berikut yang merupakan ciri khas dari ikatan kovalen antara atom C pada benzena adalah ….
A. memiliki 3 ikatan kovalen tunggal dan 3 ikatan rangkap
B. terdapat 3 ikatan rangkap selang seling yang terkonjugasi
C. 3 ikatan kovalen rangkapnya mudah diadisi
D. 3 ikatan kovalen tunggalnya mudah disubstitusi
E. ke 6 ikatan antara atom C-nya mudah disubstitusi
JAWABAN BENAR
B.
terdapat 3 ikatan rangkap selang seling yang terkonjugasi
PEMBAHASAN
Ketiga ikatan rangkap pada benzena menjadi ciri khas benzena karena tidak ada senyawa lain yang menyerupai sifat ini. Karena benzena rumus molekulnya C6H6 dan rantai atom C-nya tertutup, maka ketiga ikatan rangkap C=C yang selang-seling ini selalu berpindah secara dinamis, dikenal mengalami resonansi. Jadi semua ikatan antara atom C dalam benzena menyatu. Karena kejadian ini, sifatnya pun menjadi berbeda dengan yang lain.
3.
Kerjakan soal berikut!
Toluena, fenol, dan stirena dikenal sebagai senyawa golongan....
A. Paraffin
B. Heterosiklik
C. Polisiklik
D. Aromatis
E. Sikloalkena
JAWABAN BENAR
D.
Aromatis
PEMBAHASAN
Toluena, fenol, dan stirena merupakan turunan dari senyawa benzena yang dikenal sebagai senyawa golongan aromatis.
4.
Jawablah soal berikut ini!
Di bawah ini tertera rumus bangun suatu senyawa turunan benzena. Nama senyawa itu adalah….

A. 1-hidroksi-2,4-dinitrofenol
B. 1,3-dinitrofenol
C. 2,4-dinitrobenzena
D. 2,4-dinitrofenol
E. 2,4-dinitrotoluena
JAWABAN BENAR
D.
2,4-dinitrofenol
PEMBAHASAN
Perhatikan deret prioritas, penomoran diberikan bagi yang memiliki prioritas paling tinggi. Yaitu:
COOH > SO3H > CHO > OH > NH2 > R > NO2 > X.
Jadi pada soal, penomoran 1 diletakkan pada OH karena OH lebih prioritas daripada NO2. NO2 berada pada penomoran 2 dan 4, karena ada 2 NO2 maka ditambahkan awalan “di”. Jadi nama senyawa tersebut adalah 2,4-dinitrofenol.
5.
Kerjakan soal berikut ini!
Nama dari senyawa turunan benzena dengan rumus struktur di bawah ini adalah....

A. 1,3-diklorofenol
B. 3,5-diklorobenzoat
C. 3,5-diklorofenol
D. 1,3-diklorobenzena
E. 3,5-diklorotoluena
JAWABAN BENAR
C.
3,5-diklorofenol
PEMBAHASAN
Perhatikan deret perioritas, penomoran diberikan bagi yang memiliki prioritas paling tinggi. Yaitu :
COOH > SO3H > CHO > OH > NH2 > R > NO2 > X.
Jadi pada soal, penomoran 1 diletakkan pada OH karena OH lebih prioritas daripada Cl. Cl berada pada penomoran 3 dan 5, karena ada 2 Cl maka ditambahkan awalan “di”. Jadi nama senyawa tersebut adalah 3,5-diklorofenol.
6.
Perhatikan sifat berikut ini!
- Merupakan senyawa nonpolar.
- Larut dalam air.
- Berbau khas.
- Tidak begitu reaktif.
- Larut dalam pelarut polar.
Berdasarkan data tersebut, sifat senyawa benzena ditunjukkan oleh nomor….
A. 1, 2, dan 3
B. 1, 2, dan 4
C. 1, 3, dan 4
D. 1, 3, dan 5
E. 1, 4, dan 5
JAWABAN BENAR
C.
1, 3, dan 4
PEMBAHASAN
Sifat senyawa benzena:
- Merupakan senyawa nonpolar.
- Tidak larut dalam pelarut polar seperti air, tetapi larut dalam pelarut yang kurang polar atau nonpolar.
- Berbau khas.
- Tidak begitu reaktif.
7.
Perhatikan persamaan reaksi berikut!
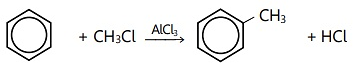
Jenis reaksi tersebut adalah….
A. adisi
B. alkilasi
C. oksidasi
D. sulfonasi
E. halogenasi
JAWABAN BENAR
B.
alkilasi
PEMBAHASAN
Reaksi alkilasi merupakan reaksi antara benzena dan alkilhalida dengan katalis AlCl3

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

