Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Kimia Unsur
MATERI
Gas Mulia

Kegunaan:
Helium (He)
- Pengisi balon udara yang ringan.
- Isi tabung penyelam (80% He, 20% O).
- Pendingin reaktor nuklir.
- Pencipta lingkungan inert.
Neon (Ne)
- Pengisi tube lamp
- reklame dan TV tabung.
- Pendingin reaktor nuklir.
- Lampu runway bandar udara.
Argon (Ar)
- Pengisi tube lamp dan bola lampu dengan kawat tungsten.
- Pencipta lingkungan inert.
Kripton (Kr)
- Pengisi lampu fluorosense, mercusuar dan runway bandar udara.
- Lampu kilat (flashtube) kamera.
Xenon (Xe)
- Pembuatan tabung elektron.
- Pembiusan pada bedah.
- Lampu blitz pada kamera.
Radon (Rn)
- Terapi radiasi penderita kanker.
Pembuatan:
- Ekstraksi dari gas alam (He)
- Proses kriogenik (He)
- Proses adsorpsi (He, Ar, Kr, dan Xe)
- Ekstraksi dari udara (He, Ne, Ar, Kr, dan Xe)
- Proses destilasi fraksional (Ar, Kr, dan Xe)
Halogen

Kegunaan:
Fluorin (F)
- NaF sebagai pengawet kayu.
- Na2SiF6 untuk campuran pasta gigi.
- HF untuk sketsa pada kaca.
Klorin (Cl)
- NaCl untuk garam dapur, pengawet makanan, dan pencair salju di jalan raya.
- ZnCl2 untuk bahan pematri/solder.
- NH4Cl sebagai pengisi baterai kering.
- HCl sebagai pembersih permukaan logam.
- NaClO sebagai pemutih pakaian.
- KCl sebagai campuran pupuk, bahan peledak, dan korek api.
Bromin (Br)
- NaBr sebagai obat penenang.
- AgBr sebagai bahan pembuat negatif film.
- CH3Br sebagai bahan pemadam kebakaran.
Iodin (I)
- AgI sebagai garam untuk fotografi.
- NH4I untuk lensa polaroid.
- Identifikasi amilum.
Pembuatan:
Unsur-unsur halogen dapat dibuat dengan jalan oksidasi, reduksi, dan elektrolisis.
Klor
- Oksidasi Dengan memanaskan campuran MnO2, NaCl, dan H2SO4 pekat.
- Elektrolisis lebur NaCl menghasilkan gas klor di anode.
- Elektrolisis lebur NaCl, dihasilkan gas Cl2 pada anode dan Na pada katode.
- Elektrolisis larutan NaCl dengan menggunakan diafragma, dihasilkan gas Cl2 pada anode dan NaOH pada katode.
Brom
- Oksidasi Dengan mengalirkan gas Cl2 ke dalam air laut.
Cl2(g) + 2Br-(aq) --> 2Cl-(aq) + Br2(aq)
Iodium
- Reduksi Dengan menambah NaHSO3 ke dalam larutan NaIO3
2IO3-(aq) + 5HSO3-(aq) --> 3HSO4-(aq) +2SO42-(aq) + H2O(l) + I2(aq)
Alkali

Kegunaan:
Litium (Li)
- Pengisi baterai litium-ion.
- Penambah daya tahan korosi Al.
Natrium (Na)
- Reduktor, menghasilkan Ti.
- Pendingin reaktor nuklir.
- Pengisi lampu jalan raya.
- NaOH untuk pembuatan sabun dan kertas.
- NaCl untuk garam dapur, pengawet makanan, dan pencair salju di jalan raya.
- NaHCO3 untuk soda kue.
- Na2CO3 untuk pengolahan air, pembuatan sabun, detergen, obat, kertas, kaca.
Kalium (K)
- KI dan KBr untuk garam pada fotografi.
- KMnO4 sebagai desinfektan.
- KCl dan K2SO4 untuk campuran pupuk.
- KNO3 sebagai bahan membuat bubuk mesiu.
- K2CO3 umumnya untuk membuat kaca terutama kaca televisi.
- KOH digunakan untuk membuat sabun cair dan detergen.
Rubidium (Rb)
- Digunakan sebagai katoda pada lampu elektronik.
- Garam rubidium (Rb) digunakan dalam gelas, keramik, dan kembang api untuk memberikan warna ungu.
- Digunakan sebagai pembersih gas dalam tabung vakum.
Cesium (Cs)
- Digunakan sebagai katoda pada lampu elektronik.
- Sesium klorida digunakan untuk sel fotoelektrik
- Sesium nitrat digunakan untuk membuat gelas optik
Pembuatan:
Logam alkali dibuat dengan elektrolisis cairan garamnya (sebagai klorida).
Reaksi : LCl(l) --> L+ + Cl-
Katode : L+ + e- --> L
Anode : 2Cl- --> Cl2 + 2e-
Alkali Tanah

Kegunaan:
Berilium (Be)
- Digunakan sebagai bahan penguat kemudi pesawat jet.
- Campuran berilium dan tembaga dipakai pada peralatan listrik seperti komponen televisi.
Magnesium (Mg)
- Aliasi magnalium (Mg-Al) untuk bahan konstruksi bangunan, kendaraan, kapal laut, pesawat terbang.
- Mencegah korosi pipa bawah tanah.
- Mg(OH)2 untuk obat maag.
- MgCl2.6H2O untuk kain, kertas, keramik.
Kalsium (Ca)
- Ca(OH)2 untuk pengolahan air dan pembuatan soda.
- CaCO3 untuk beton, batu bata dan marmer bangunan.
- CaO digunakan dalam industri besi, semen, soda dan kaca.
- CaC2 untuk membuat gas asetilena (C2H2)
Stronsium (Sr)
- Digunakan untuk membuat nyala merah pada kembang api, nyala api mercusuar, dan bahan cat.
- Digunakan sebagai senyawa karbonat dalam pembuatan kaca televisi yang masih menggunakan tabung sinar katoda.
Barium (Ba)
- Barium sulfat yang digunakan sebagai obat untuk penderita gangguan pencernaan.
- Barium karbonat yang digunakan dalam racun tikus.
- Digunakan untuk membuat nyala hijau pada kembang api, dan cat.
Radium (Ra)
- Radium disuntikkan kepada penderita kanker prostat yang sudah menyebar ke tulang.
Pembuatan:
Logam alkali tanah dibuat dengan elektrolisis garam klorida cairannya.
Reaksi : MCl2 --> M2+ + 2Cl-
Katode : M2+ + 2e- --> M
Anode : 2Cl- --> Cl2 + 2e-
Nitrogen dan Oksigen

Nitrogen
Kegunaan Nitrogen (N):
- Penyusun molekul protein, RNA dan DNA.
- Pencipta lingkungan inert.
- NH3, untuk bahan baku pupuk urea dan ZA, cairan pendingin, dan membuat senyawa nitrogen lain.
- HNO3, untuk bahan baku peledak TNT, nitrogliserin dan nitroselulosa.
Pembuatan:
Dalam teknik/industri: dengan distilasi udara cair.Dalam laboratorium : dengan memanaskan NH4NO2
NH4NO2(s) --> 2H2O(l) + N2(g)
Senyawa yang penting:
NH3 : dibuat dengan Proses Haber–Bosch
N2(g) + 3H2(g) --> 2NH3(g)
Sebagai bahan baku pembuatan pupuk urea. HNO3 (asam nitrat): dibuat dengan proses Ostwald.
Oksigen
Kegunaan Oksigen (O):
- Oksidator universal reaksi kimia.
- O3, pelindung bumi dari radiasi sinar UV.
- Penerima elektron terakhir respirasi aerob.
Pembuatan:
- Proses elektrolisis air.
- Proses penyulingan udara.
- Memanaskan garam tertentu dan oksida logam berat
2KClO3(s) --> 2KCl(s) + 3O2(g)
2HgO(s) --> 2Hg(l) + O2(g)
Unsur-unsur Periode Ketiga

Kegunaan:
Natrium (Na)
- Reduktor, menghasilkan Ti.
- Pendingin reaktor nuklir.
- Pengisi lampu jalan raya.
- NaOH untuk pembuatan sabun dan kertas.
- NaCl untuk garam dapur, pengawet makanan, dan pencair salju di jalan raya.
- NaHCO3 untuk soda kue.
- Na2CO3 untuk pengolahan air, pembuatan sabun, detergen, obat, kertas, kaca.
Magnesium (Mg)
- Aliasi magnalium (Mg-Al) untuk bahan konstruksi bangunan, kendaraan, kapal laut, pesawat terbang.
- Mencegah korosi pipa bawah tanah.
- Mg(OH)2 untuk obat maag.
- MgCl2.6H2O untuk kain, kertas, keramik.
Aluminium (Al)
- Aliasi magnalium (Mg-Al)
- untuk bahan konstruksi bangunan, kendaraan, kapal laut, pesawat terbang.
- Bahan peralatan dapur dan kemasan kaleng.
- KAl(SO4)2, tawas untuk penjernihan air.
Silikon (Si)
- Bahan baku microprocessor komputer, kalkulator dan baterai solar.
- Bahan baku kaca, tanah liat dan semen.
- Na2SiO3 untuk bahan pembuatan sabun.
Fosfor (P)
- Alotrop fosfor (P4): fosfor merah untuk korek api dan kembang api, fosfor putih untuk racun tikus.
Klorin (Cl)
- NaCl untuk garam dapur, pengawet makanan, dan pencair salju di jalan raya.
- ZnCl2 untuk bahan pematri/solder.
- NH4Cl sebagai pengisi baterai kering.
- HCl sebagai pembersih permukaan logam.
- NaClO sebagai pemutih pakaian.
- KCl sebagai campuran pupuk, bahan peledak, dan korek api.
Argon (Ar)
- Digunakan sebagai bahan pengisi bola lampu pijar dan neon.
Pembuatan:
Natrium
Dibuat dengan cara elektrolisis leburan NaCl
Reaksi : NaCl(l) --> Na+ + Cl-
Katode : Na+ + e- --> Na
Anode : 2Cl- --> Cl2 + 2e-
Natrium tidak dapat dibuat dengan elektrolisis air laut.Natrium disimpan dalam minyak tanah.
Magnesium
Dibuat dengan cara elektrolisis lelehan MgCl2.
Reaksi : MgCl --> Mg2+ + 2Cl-
Katoda : Mg2+ + 2e- --> Mg
Anoda : Cl2 --> 2Cl- + 2e
Aluminium
Dibuat dengan elektrolisis dari bauksit yang murni (proses Hall-Heroult)
- Al2O3 murni dicampur dengan Na3AIF (kriolit) untuk menurunkan titik leleh Al2O3 dan bertindak sebagai pelarut untuk pemurnian Al2O3.
- Dielektrolisis, reaksi yang terjadi:
Al2O3 --> Al3+ + O2-
Katode (grafit) : 4Al3+ + 12e- --> 4Al
Anode (grafit) : 3C + 6O2- --> 3CO2 + 12e-
3C + 4Al3+ + 6O2- --> 4Al + 3CO2
Silikon
Dibuat dengan mereduksi SiO2 dengan karbon:
- SiO2 + C --> Si + 2CO
Fosfor
Dibuat dengan proses Wohler:
- Reaksi dalam tanur listrik
2Ca3(PO4)2(l) + 6SiO2(l) --> 6CaSiO3(l) + P4O10(g) - Reduksi
P4O10(g) + 5C(s) --> P4(s) + 5CO2(g)
Fosfor putih lalu disimpan dalam CS2 atau H2O agar tidak teroksidasi
Sulfur
- Dibuat dengan Proses Frasch (proses pengambilan belerang dari bawah permukaan tanah) yang kemudian dicairkan dengan dialiri air bersuhu 1600oC dan bertekanan 16 atm.
- Dan juga diperoleh dengan proses Sisilia (proses pengambilan belerang di permukaan tanah). Mineral dipanaskan hingga belerang terpisah, kemudian dimurnikan dengan cara sublimasi.
Klor
- Oksidasi dengan memanaskan campuran MnO2, NaCl, dan H2SO4 pekat.
MnO2(s) + 2Cl-(aq) + 4H+(aq) -->Cl2(g) + Mn2+(aq) + 2H2O(l)
- Elektrolisis lebur NaCl, dihasilkan gas Cl2 pada anode dan Na pada katode.
2Na+(l) + 2Cl-(l) --> 2Na(s) + Cl2(g)
- Elektrolisis larutan NaCl dengan menggunakan diafragma, dihasilkan gas Cl2 pada anode dan NaOH pada katode.
2NaCl + 2H2O --> H2 + Cl2 + 2NaOH
Unsur Transisi Periode Keempat

Kegunaan:
Skandium (Sc)
- Lampu listrik intensitas tinggi.
Titanium (Ti)
- Bahan konstruksi tank dan roket.
- Bahan implan gigi, penyambung tulang, struktur penahan katup jantung.
Vanadium (V)
- Ferovanadium digunakan dalam peralatan teknik yang tahan getaran, misal pegas, per mobil, pesawat terbang, dan kereta api.
Kromium (Cr)
- Logam penyepuh (elektroplating).
- Campuran aliasi dan pelapis logam.
- H2CrO4 untuk membersihkan peralatan lab.
Mangan (Mn)
- MnO2 sebagai pengisi baterai kering.
- MnO42- sebagai oksidator kuat.
Besi (Fe)
- Logam utama dalam campuran aliasi.
- Penggunaan pada berbagai barang, seperti konstruksi bangunan, peralatan dapur, kendaraan, dll.
Kobalt (Co)
- Isotop radioaktri kobalt (Co-60) berguna dalam pengobatan kanker.
- Ion Co2+ dalam bentuk larutan sebagai bahan tinta.
- Kobalt banyak dimanfaatkan dalam pembuatan mesin jet, mesin turbin, dan peralatan tahan panas.
Nikel (Ni)
- Pembuatan baja tahan karat (stainless steel).
- Aliasi alniko (Al-Ni-Co) untuk magnet.
Tembaga (Cu)
- Aliasi kuningan (Cu-Zn) untuk kabel listrik.
- Aliasi perunggu (Cu-Sn) untuk medali.
Seng (Zn)
- Sebagai atap seng.
- Bahan pembuat alat elektronik.
Pengolahan:
Scandium
Elektrolisis cairan ScCl3 yang dicampur dengan klorida lain.
Titanium
Mengalirkan gas klorin pada TiO2 sehingga terbentuk TiCl4
TiO2(s) + 2C(s) + 2Cl2(g) -->TiCl4(s) + 2CO(g)
TiCl4 yag direduksi dengan logam Mg pada suhu tinggi yang bebas oksigen
TiCl4(s) + 2Mg(s) -->Ti(s) + 2MgCl2(s)
Vanadium
Reduksi V2O5 dengan campuran siliko dan besi
2V2O5(s) + 5Si(s) + Fe(s) -->4V (+Fe)(s) + 5SiO2(s)
Kromium
Proses Goldschmidt
Cr2O3(s) + 2Al(s) --> Al2O3(s) + 2Cr(s)
Mangan
Proses aluminotermi
3MnO2(s) --> Mn3O4(s) + O2(g)
3Mn3O4(s) + 8Al(s) --> 9Mn(s) + 4Al2O3(s)
Tembaga
- Bahan baku adalah kalkopirit, CuFeS.
- Pengolahan dengan proses oksidasi reduksi.
- Bagan pengolahan tembaga sebagai berikut:

Besi
- Bahan baku terdiri atas: bijih besi, Fe2O3 atau Fe2O4, CaCO3, atau SiO2 kokas (C).
- Pengolahan dengan proses tanur tinggi.
- Bagan pengolahan besi dengan proses tanur tinggi.
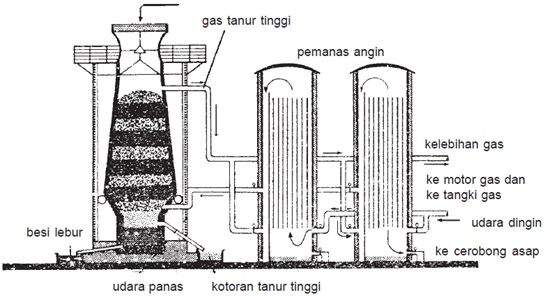
Seng
Pemanggangan ZnS kemudian dioksida seng direduksi dengan karbon pijar
2ZnS(s) + 3O2(g) -->2ZnO(s) + 2SO2(g)
ZnO(s) + C(s) -->Zn(g) + CO(g)
1.
Jawablah soal berikut!
Senyawa yang digunakan sebagai obat Penyakit Maag adalah...
A. MgO
B. MgSO4
C. NaOH
D. MgCl2
E. MgS
JAWABAN BENAR
A.
MgO
PEMBAHASAN
Senyawa yang digunakan sebagai obat penyakit Maag adalah MgO.
2.
Kerjakan soal berikut!
Yang bukan merupakan pernyataan yang benar mengenai senyawa NaOH adalah....
A. disebut sebagai soda api
B. bahan baku pembuatan sabun
C. bahan baku pembuatan plastik
D. bahan baku pembuatan detergen
E. bahan baku pembuatan serat rayon
JAWABAN BENAR
C.
bahan baku pembuatan plastik
PEMBAHASAN
NaOH : Disebut soda api. Digunakan sebagai bahan baku untuk pembuatan sabun, detergen, kertas, serat rayon.
3.
Kerjakan soal berikut dengan tepat!
Senyawa berikut yang digunakan sebagai obat penenang adalah....
A. O2
B. NaBr
C. NaOH
D. Mg(OH)2
E. KCl
JAWABAN BENAR
B.
NaBr
PEMBAHASAN
Yang digunakan sebagai obat penenang adalah senyawa NaBr.
4.
Kerjakan soal berikut dengan tepat!
Cara untuk memperoleh unsur Brom adalah dengan cara....
A. Oksidasi dengan gas Cl2 ke dalam air laut
B. Elektrolisis leburan HBrO2
C. Destilasi udara cair
D. Elektrolisis garam klorida
E. Dengan menggunakan pemanasan NH4NO2
JAWABAN BENAR
A.
Oksidasi dengan gas Cl2 ke dalam air laut
PEMBAHASAN
Unsur Brom dapat diperoleh dengan cara oksidasi dengan gas Cl2 ke dalam air laut menurut reaksi:
Cl2 + 2Br- --> 2Cl- + Br2
5.
Jawablah soal berikut ini!
Kandungan stainless steel yang dapat membuat baja bersifat tahan karat adalah ....
A. Mn dan Fe
B. Cr, Ni, dan Fe
C. Cr dan Ni
D. Cr, Mn, dan Fe
E. Cu dan Zn
JAWABAN BENAR
C.
Cr dan Ni
PEMBAHASAN
Cr dan Ni merupakan unsur pembuat stainless steel tahan karat.
6.
Kerjakan soal berikut ini!
Logam krom dibuat dengan cara mereduksi Cr2O3 dengan logam aluminium melalui reaksi:
Cr2O3(s) + 2Al(s) --> Al2O3(s) + 2Cr(s)
Proses pengolahan unsur tersebut dikenal dengan….
A. Frasch
B. Kontak
C. Wohler
D. Goldschmidt
E. Hall-Heroult
JAWABAN BENAR
D.
Goldschmidt
PEMBAHASAN
Proses Goldschmidt
Cr2O3(s) + 2Al(s) --> Al2O3(s) + 2Cr(s)
7.
Kerjakan soal berikut ini!
Senyawa dari unsur halogen yang dapat digunakan sebagai pemutih adalah…
A. HF
B. NaCl
C. NaClO
D. HCl
E. AgBr
JAWABAN BENAR
C.
NaClO
PEMBAHASAN
NaClO merupakan senyawa yang berfungsi sebagai pemutih pakaian.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

