Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Reaksi Redoks dan Elektrokimia
MATERI
Pengertian Korosi


Korosi adalah kerusakan atau degradasi logam akibat reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa sehari-hari, korosi disebut perkaratan. Contoh korosi yang paling lazim adalah perkaratan besi.
Pada peristiwa korosi, logam mengalami oksidasi, sedangkan oksigen (udara) mengalami reduksi, Karat logam umumnya adalah berupa oksida atau karbonat. Rumus kimia karat besi adalah Fe2O3.nH2O, suatu zat padat yang berwarna coklat-merah.
Korosi merupakan proses elektrokimia. Pada korosi besi, bagian tertentu dari besi itu berlaku sebagai anoda, di mana besi mengalami oksidasi.
Fe(s) <==> Fe2+(aq) + 2e-
Elektron yang dibebaskan di anode mengalir ke bagian lain dari besi itu yang bertindak sebagai katode, di mana oksigen tereduksi.
O2(g) + 4H+(aq) + 4e- <==> 2H2O(l)
atau
O2(g) + 2H2O(l) + 4e- <==> 4OH-(aq)
Ion besi(II) yang terbentuk pada anode selanjutnya teroksidasi membentuk ion besi(III) yang kemudian membentuk senyawa oksida terhidrasi, yaitu karat besi.
Mengenai bagian mana dari besi itu yang bertindak sebagai anode dan bagian mana yang bertindak sebagai katode, bergantung pada berbagai faktor, misalnya zat pengotor, atau perbedaan rapatan logam itu.
Pengkaratan Besi

Korosi atau perkaratan sangat lazim terjadi pada besi. Besi merupakan logam yang mudah berkarat. Karat besi merupakan zat yang dihasilkan pada peristiwa korosi, yaitu berupa zat padat berwarna coklat kemerahan yang bersifat rapuh serta berpori.
Rumus kimia dari karat besi adalah Fe2O3.xH2O. Bila dibiarkan, lama kelamaan besi akan habis menjadi karat.
Peristiwa korosi sendiri merupakan proses elektrokimia, yaitu proses (perubahan / reaksi kimia) yang melibatkan adanya aliran listrik. Bagian tertentu dari besi berlaku sebagai kutub negatif (elektroda negatif, anoda), sementara bagian yang lain sebagai kutub positif (elektroda positif, katoda). Elektron mengalir dari anoda ke katoda, sehingga terjadilah peristiwa korosi.
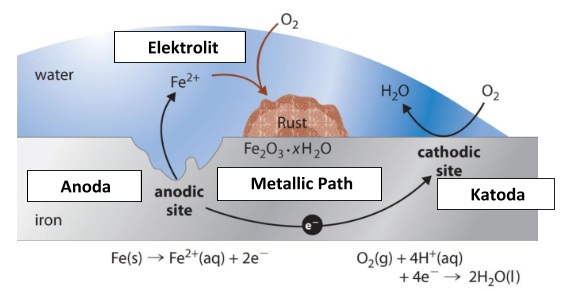
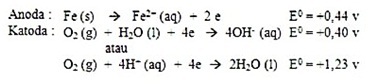
Ion besi (II) yang terbentuk pada anoda selanjutnya teroksidasi menjadi ion besi (III) yang kemudian membentuk senyawa oksida terhidrasi (karat besi), Fe2O3.xH2O.
Pencegahan Korosi

Cara Pencegahan Korosi
Agar tidak timbul banyak kerugian dari akibat peristiwa korosi, maka diperlukan suatu cara-cara pencegahan. Model pertama yang digunakan adalah bagaimana menghindari atau menghilangkan kontak langsung antara logam dengan udara atau oksigen dan air sebagai penyebab utama terjadinya korosi.
Secara mekanis permukaan logam yang hendak dilindungi ditutup dengan bahan tertentu misalnya dengan cat. Selain itu metode lain yang digunakan adalah perlindungan katodik, dimana logam yang hendak dilindungi dihubungkan dengan logam lain yang memiliki potensial elektroda lebih kecil.
Metode atau cara yang umum digunakan antara lain sebagai berikut:
- Pengecatan
- Pelumuran dengan Oli atau Gemuk
- Perlindungan Katodik
- Pelapisan Timah
- Pelapisan Aluminium
- Pelapisan dengan Kromium
- Galvanisasi
- Pencampuran logam
- Pelapisan dengan plastik
Faktor yang memengaruhi terjadinya korosi antara lain:
- Kelembaban udara
- Elektrolit
- Zat terlarut pembentuk asam (CO2, SO2)
- Adanya O2
- Lapisan pada permukaan logam
- Letak logam dalam deret potensial reduksi
1.
Jawablah soal berikut dengan benar!
Rumus molekul dari karat pada besi adalah...
A. NaCl
B. Fe
C. Fe2+
D. Fe2O3.xH2O
E. Fe(OH)2
JAWABAN BENAR
D.
Fe2O3.xH2O
PEMBAHASAN
Rumus molekul dari karat besi adalah Fe2O3.xH2O
2.
Jawablah soal berikut dengan benar!
Berikut ini adalah cara pencegahan korosi, kecuali...
A. pengecatan
B. menambah kelembaban
C. perlindungan katodik
D. galvanisasi
E. pelumuran dengan oli
JAWABAN BENAR
B.
menambah kelembaban
PEMBAHASAN
Metode atau cara umum dalam pencegahan korosi antara lain sebagai berikut:
- Pengecatan
- Pelumuran dengan Oli atau Gemuk
- Perlindungan Katodik
- Pelapisan Timah
- Pelapisan Aluminium
- Pelapisan dengan Kromium
- Galvanisasi
- Pencampuran logam
- Pelapisan dengan plastik
3.
Jawablah soal berikut dengan benar!
Di daerah industri, udara dapat mengandung gas-gas SO2, CO2, O2, N2, CO dan H2O. Pasangan gas-gas yang dapat menyebabkan terjadinya korosif adalah....
A. O2 dan N2
B. CO dan N2
C. CO2 dan SO2
D. SO2 dan H2O
E. CO dan H2O
JAWABAN BENAR
C.
CO2 dan SO2
PEMBAHASAN
Korosif (kerusakan oleh asam) disebabakan oleh asam, pada daerah pegunungan berapi SO2 yang bercampur air diudara mampu membentuk hujan asam, pada daerah industri CO2 akan membentuk asam jika bereaksi dengan air.
4.
Jawablah soal berikut dengan benar!
Manakah hal berikut yang dapat mempercepat terjadinya korosi besi ?
A. besi dicat
B. besi dihubungkan dengan logam Mg
C. besi dihubungkan dengan logam Cu
D. besi dilapisi oleh timah
E. besi diberi oli
JAWABAN BENAR
C.
besi dihubungkan dengan logam Cu
PEMBAHASAN
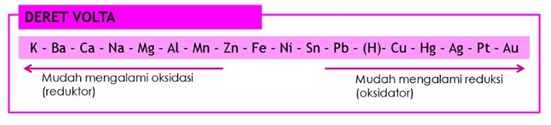
Fe akan cepat berkarat jika dilapisi logam di sebelah kananya.
Logam Cu berada pada sisi kanan Fe.
5.
Jawablah soal berikut dengan benar!
Untuk mencegah terjadinya korosi pipa besi yang ditanam dalam tanah, pipa besi dihubungkan dengan logam....
A. Mg
B. Zn
C. Ag
D. Pb
E. Sn
JAWABAN BENAR
A.
Mg
PEMBAHASAN
Untuk melindungi besi dari korosi, maka di sekitar besi ditempatkan logam-logam yang memiliki Eo lebih kecil yaitu terletak sebelah kiri dari besi dari deret volta.

Logam Mg berada pada sisi kiri logam besi.
6.
Jawablah soal berikut dengan benar!
Faktor-faktor yang berasal dari lingkungan berikut ini dapat mempengaruhi korosi kecuali….
A. Suhu
B. Udara
C. Keasaman
D. Kelembapan
E. Struktur Bahan
JAWABAN BENAR
E.
Struktur Bahan
PEMBAHASAN
Ada beberapa faktor yang dapat mempengaruhi korosi :
- Udara yang mengandung air
- Keasaman (pH)
- Kontak dengan zat elektrolit
- Suhu
7.
Jawablah soal berikut dengan benar!
Mudah atau tidaknya logam berkarat tergantung pada ...
A. Banyaknya air
B. Keaktifan logam
C. Suhu lingkungan
D. Tingkat kebasaan
E. Banyaknya oksigen
JAWABAN BENAR
B.
Keaktifan logam
PEMBAHASAN
Proses korosi pada logam terutama besi disebabkan oleh permukaan logam mempunyai kerekatifan yang berbeda beda. Besi yang lebih reaktif akan mengalami reaksi oksidasi membentuk ion Fe2+ dan sejumlah elektron dan bertindak sebagai anode. Elektron yang dihasilkan akan mengalir ke bagian logam yang kurang reaktif yaitu bagian katode. Sementara itu ion Fe2+ yang dihasilkan akan masuk ke dalam air yang mengalami oksidasi lanjut membentuk ion Fe3+ yang kemudian akan senyawa oksida terhidrasi berupa Fe2O3.x H2O (karat besi yang rapuh).

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

