Materi Kimia - Ikatan Kimia Kelas 11 - Belajar Pintar
BelajarPintarV3
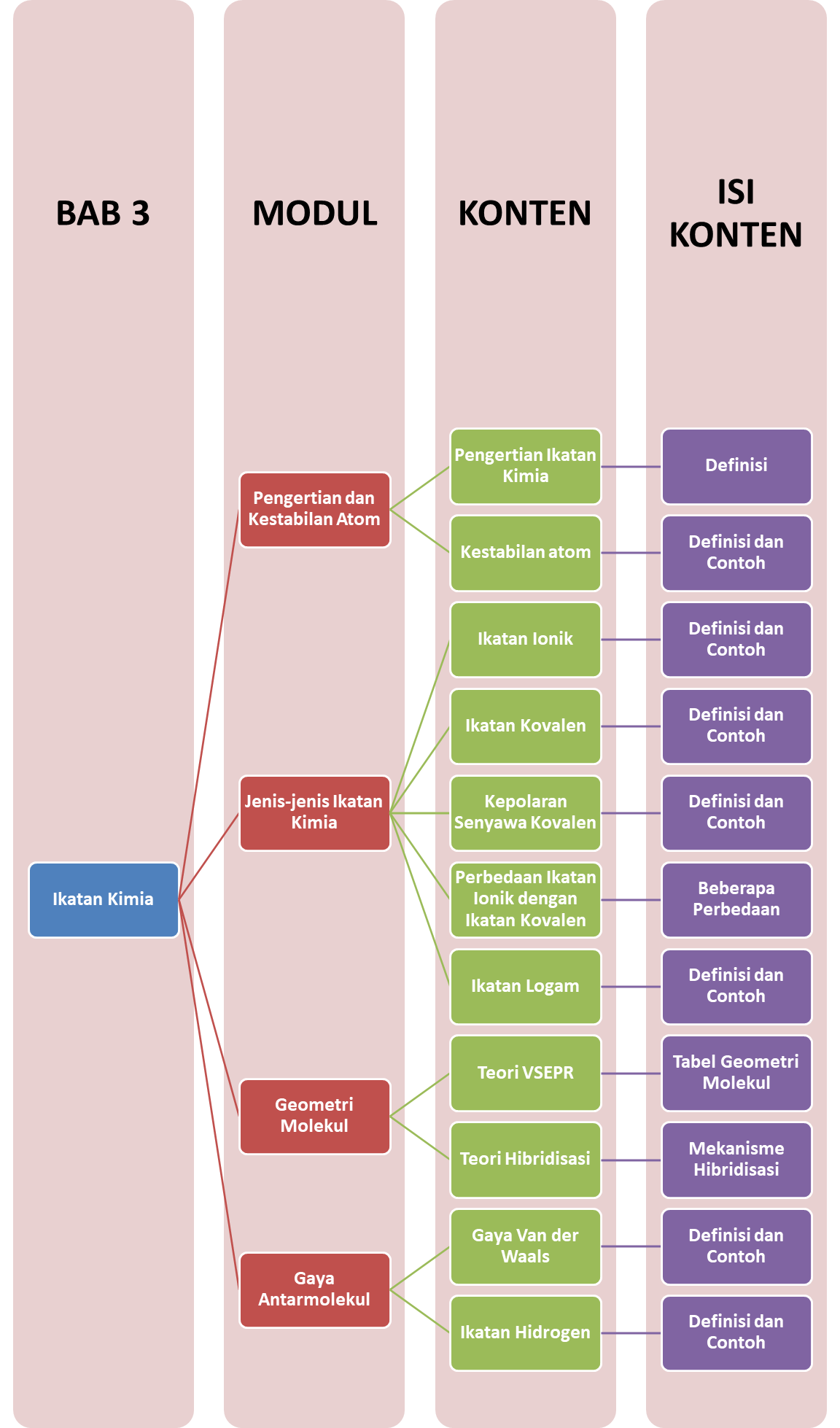
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab ketiga.
Yuk, mulai belajar bersama!
Pengertian Ikatan Kimia

Kita semua tahu bahwa manusia merupakan makhluk sosial yang membutuhkan manusia lainnya untuk saling membantu satu sama lain dengan begitu manusia juga membentuk ikatan antar manusia lainnya seperti, ikatan teman, ikatan keluarga, ikatan saudara, dan juga ikatan cinta.
Sama halnya dengan manusia, setiap unsur dalam bentuk atom juga dapat membentuk suatu ikatan dengan atom yang lainnya dengan adanya suatu ikatan kimia.
Ikatan kimia adalah ikatan antara atom-atom untuk membentuk senyawa, sehingga mencapai kestabilan. Secara umum, ikatan kimia yang kuat diasosiasikan dengan transfer elektron antara dua atom yang berpartisipasi. Ikatan kimia menjaga molekul-molekul, kristal, dan gas-gas diatomik untuk tetap bersama. Selain itu ikatan kimia juga menentukan struktur dan sifat suatu zat.
Macam-macam ikatan kimia diantaranya:
- Ikatan ion
- Ikatan kovalen
- Ikatan logam
Selain itu, antar molekul yang berdekatan juga dapat mengalami suatu gaya tarik menarik, macam-macam gaya antar molekul tersebut adalah sebagai berikut:
- Gaya London
- Gaya dipol-dipol
- Gaya Van der Waals
- Ikatan hidrogen
Ikatan Ion

Ikatan ion adalah ikatan yang terjadi:
- Berdasarkan serah terima/perpindahan elektron.
- Antara ion positif dan ion negatif.
- Antara unsur logam dan non-logam.
- Antara unsur golongan IA dan IIA (+) dan golongan VIA dan VIIA (-).
Contoh senyawa ion antara lain: NaCl, MgCl2, CaCl2, KOH, KCl, dll.
Pembentukan Ikatan Ion
Ikatan ion terjadi karena atom-atom yang mempunyai energi ionisasi rendah (mudah melepas elektron) akan melepaskan elektronnya dan membentuk ion positif. Elektron yang dilepas akan ditangkap oleh atom yang mempunyai afinitas elektron besar (mudah menarik elektron) untuk membentuk ion negatif. Selanjutnya ion positif dan negatif akan saling Tarik menarik dengan gaya elektrostatis membentuk senyawa yang tidak bermuatan (netral). Sebagai contoh pembentukan ikatan ion pada NaCl sebagai berikut.
Berdasarkan kaidah oktet, untuk mencapai kestabilannya, atom Na harus melepaskan 1 elektron, sedangkan atom Cl membutuhkan 1 elektron. Atom Na akan bermuatan positif, sedangkan atom Cl akan bermuatan negatif. Dengan demikian, atom Na dan Cl dapat mencapai kestabilannya dengan cara serah terima elektron. Atom Na menyerahkan 1 elektron kepada atom Cl sehingga atom Cl menerima 1 elektron dari atom Na.
Karena berbeda muatan, ion Na+ dan ion Cl- akan saling tarik-menarik. Interaksi yang dinamakan interaksi elektrostatik ini berlangsung secara terus menerus. Reaksi pembentukannya digambarkan sebagai berikut:
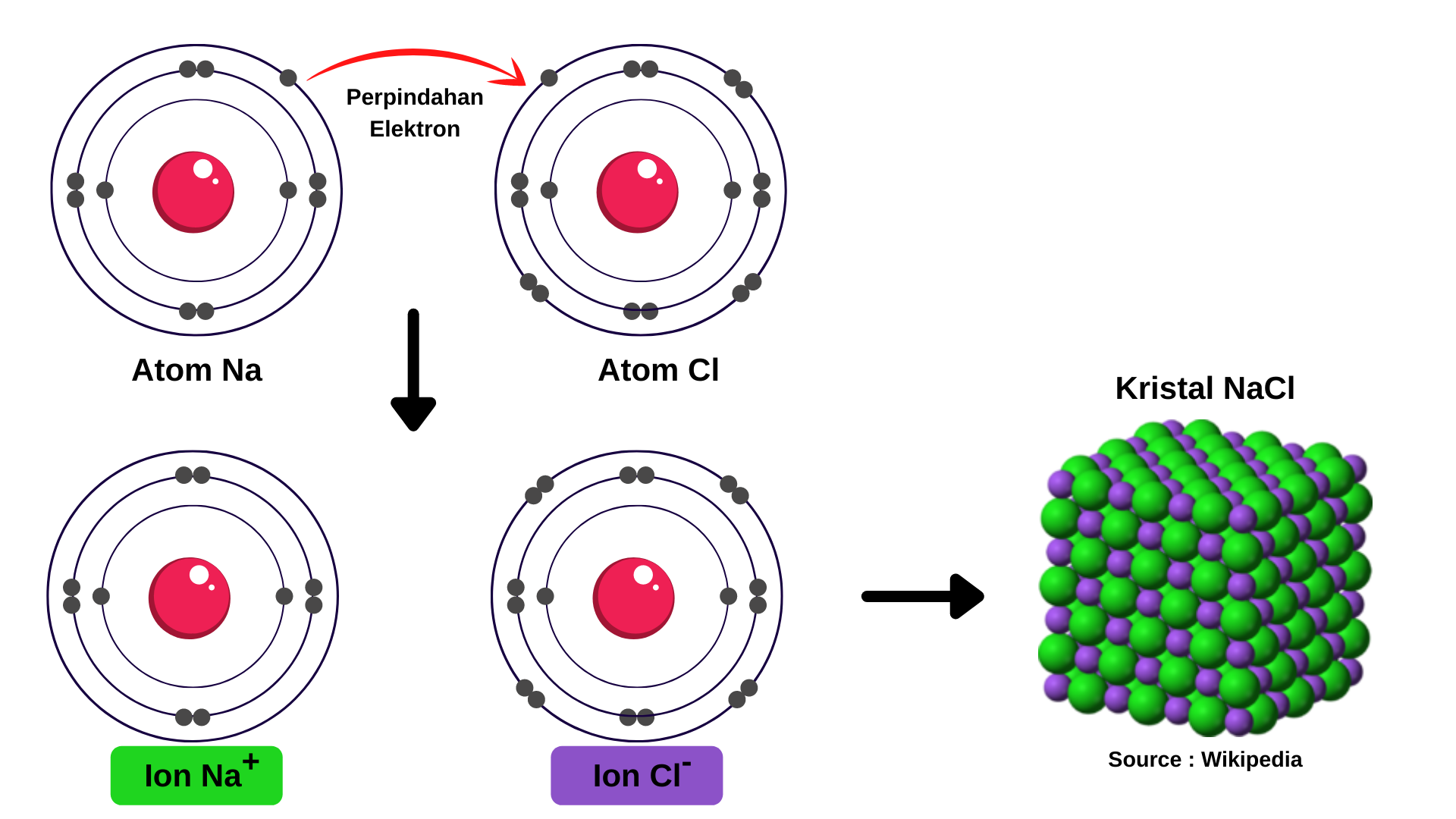
Senyawa yang terbentuk melalui ikatan ion disebut senyawa ion.
Sifat-sifat Senyawa Ion antara lain:
- Kristalnya keras tetapi rapuh.
- Mempunyai titik lebur dan titik didih yang tinggi.
- Mudah larut dalam air.
- Dapat menghantarkan arus listrik.
Teori VSEPR

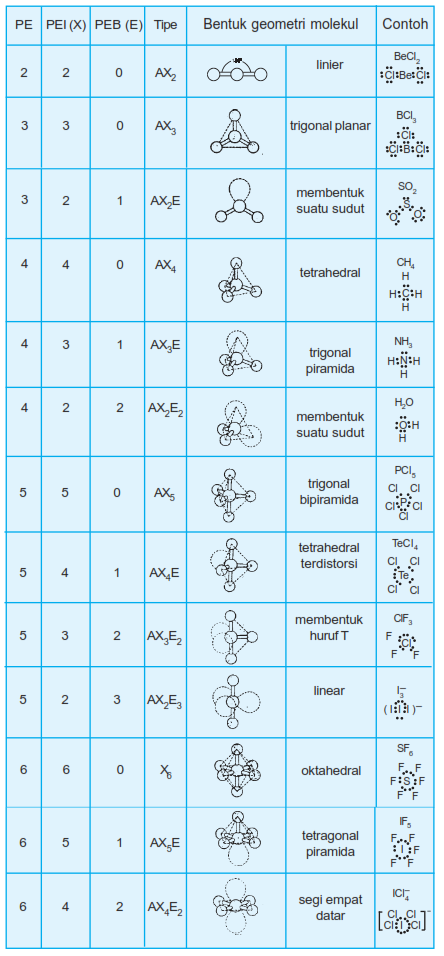
Bentuk molekul berhubungan dengan posisi atom-atom dalam suatu molekul. Bentuk molekul menggambarkan posisi atom-atom dalam ruang tiga dimensi dan besarnya sudut ikatan yang terjadi dalam ikatan kovalen dalam suatu molekul.
Teori VSEPR (Valence Shell Electron Pair Repulsion) adalah suatu cara untuk meramalkan geometri molekul berdasarkan tolak menolak elektron pada kulit luar atom pusat. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron. Teori ini didasarkan pada gagasan pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB) di sekitar atom pusat dan akan mengatur posisinya sebisa mungkin saling menjauh satu sama lain.
Meramalkan Bentuk Molekul berdasarkan Teori VSEPR
Langkah-langkah dalam penentuannya sebagai berikut:
- Membuat konfigurasi elektron
- Menentukan elektron valensi
- Membuat struktur Lewis
- Menentukan PEI dan PEB pada atom pusat
- Menentukan bentuk molekulnya
Rumus pasangan elektron dalam suatu molekul disimbolkan sebagai berikut:
AXnEm
Keterangan :
A = atom pusat
X = pasangan elektron ikatan
E = pasangan elektron bebas
n = jumlah pasangan elektron ikatan
m = jumlah pasangan elektron bebas
Berikut tabel geometri bentuk molekul:
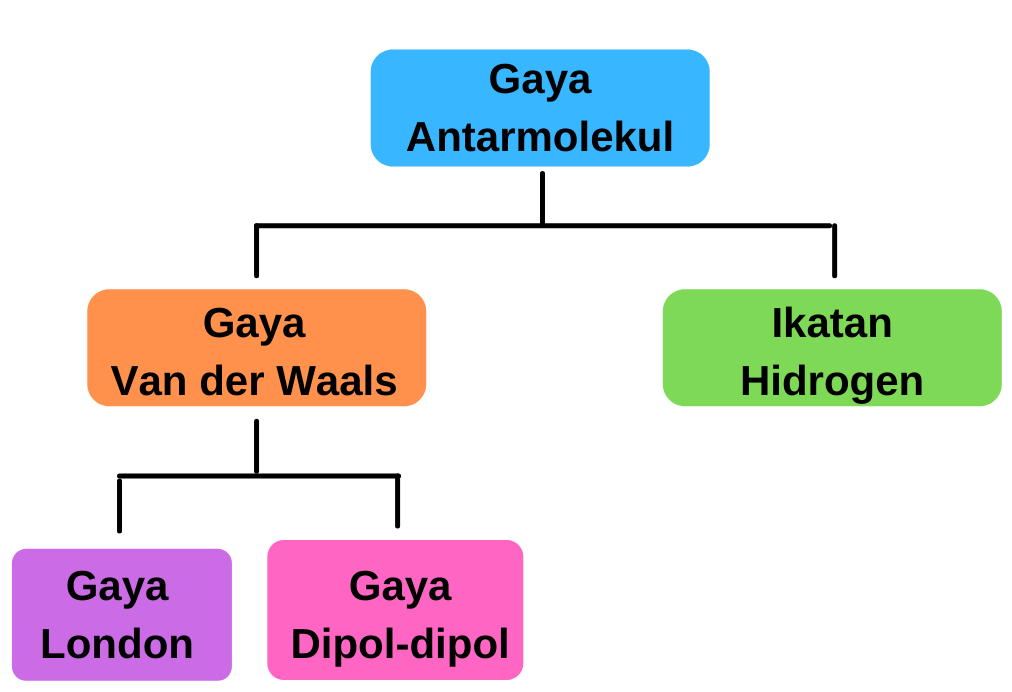
Gaya Antarmolekul: Gaya Van der Waals

Gaya antarmolekul adalah gaya yang terjadi akibat interaksi antar molekul sejenis. Terbagi menjadi Gaya Van der Waals dan Ikatan Hidrogen. Gaya Van der Waals terbagi lagi menjadi Gaya London dan Gaya Dipol-dipol.
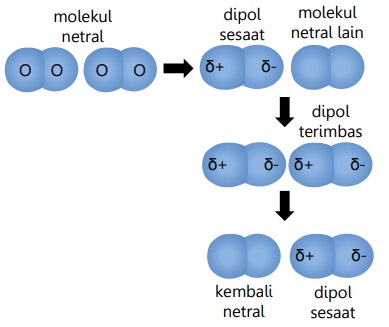
Gaya London atau gaya dipol sesaat/terimbas adalah gaya tarik-menarik dipol yang terjadi pada molekul non-polar dan/atau berwujud gas.
Gaya London terjadi akibat terbentuknya dipol sesaat, dan memiliki daya tarik-menarik yang lemah, karena hanya terjadi sesaat.
Contoh: gaya antar molekul O2
Faktor-faktor yang mempengaruhi gaya London:
- Massa relatif/Ar/Mr (berbanding lurus)
- Panjang rantai molekul (berbanding lurus)
- Titik didih zat (berbanding lurus)
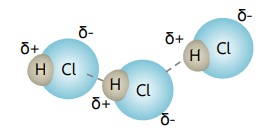
Gaya tarik dipol-dipol adalah gaya tarik menarik dipol yang terjadi antar molekul polar dan/atau wujud padat, cair dan larutan.
Gaya tarik dipol-dipol terjadi karena adanya dipol pada molekul, dan memiliki daya tarik menarik yang lebih kuat dari gaya London.
Contoh: gaya antar molekul HCl.
Faktor-faktor yang mempengaruhi gaya tarik dipol-dipol:
- Beda keelektronegatifan (berbanding lurus)
- Momen dipol (berbanding lurus)
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved