Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Hukum Dasar Kimia, Konsep Mol, dan Stoikiometri
MATERI
Mol dan Massa molar

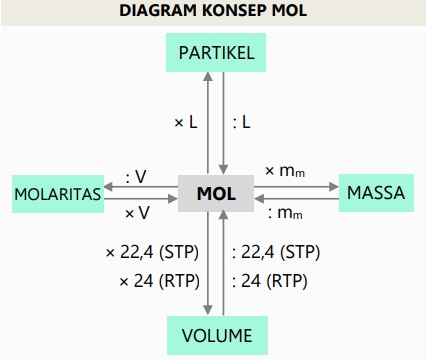
Mol merupakan satuan yang menunjukkan ukuran jumlah partikel yang ada dalam suatu zat apapun.
Nilai mol dinotasikan dengan L yang disebut sebagai tetapan Avogadro.
L = 6,02 x 1023 partikel/atom/molekul
Jumlah partikel benda dapat dicari menggunakan konsep mol, dapat dirumuskan:

Massa molar (mm) adalah massa penyusun suatu atom/senyawa benda.
Massa molar dapat ditentukan dengan menjumlahkan Ar penyusun atom atau Mr pada senyawa benda.
Contoh:
CO2 memiliki Mr 44 gr/mol, karena Ar C = 12 gr/mol, dan Ar O = 16 gr/mol.
Dengan menggunakan massa molar dan konsep mol, kita dapat mencari massa nyata suatu atom/senyawa, dapat dirumuskan:
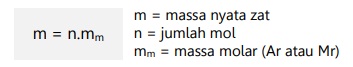
Volume Molar

Volume molar (Vm) adalah volume yang dimiliki oleh gas berdasarkan keadaan ruang yang ditempati gas tersebut.
Pada Hukum Gay-Lussac dan Hipotesis Avogadro, telah disebutkan bahwa volume gas tidak dilihat dari jenis gas, melainkan keadaan ruang gas.
Nilai volume molar dalam dua keadaan:
- STP (Standard Temperature & Pressure)
STP (keadaan standar) memiliki keadaan dengan suhu 0oC, tekanan 1 atm.
Vm = 22,4 L/mol - RTP (Room Temperature & Pressure)
RTP (keadaan kamar) memiliki keadaan ruang dengan suhu 25oC, tekanan 1 atm.
Vm = 24 L/mol
Volume nyata gas dalam dua keadaan tersebut dapat dirumuskan:
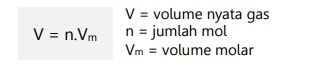
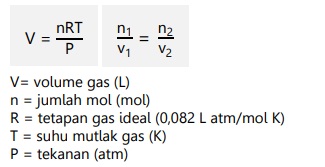
Apabila gas berada tidak pada keadaan standar (STP) maupun keadaan kamar (RTP), dapat digunakan persamaan gas ideal yang dikemukakan oleh Gay-Lussac.
Kemolaran Larutan

Kemolaran larutan adalah angka yang menunjukkan banyaknya mol tiap 1 liter larutan.
Contoh:
Suatu larutan HCl kemolarannya 1,0 M, berarti terdapat 1 mol HCl dalam 1 liternya.
Jumlah mol dalam larutan dapat dihitung dengan:

1. Hitunglah volume 9,03 x 1023 molekul uap air (Mr = 18) pada keadaan standar.
A. 33,6
B. 22,4
C. 11,2
D. 16,8
E. 5,6
JAWABAN BENAR
A.
33,6
PEMBAHASAN

2. Hitunglah jumlah mol dari 54 g Al dalam sebuah perabotan rumah tangga (Ar Al = 27).
A. 5 mol
B. 4 mol
C. 3 mol
D. 2 mol
E. 1 mol
JAWABAN BENAR
D.
2 mol
PEMBAHASAN
3.
Jawablah soal berikut ini!
Berapa mol dari 63,8 gram tembaga (II) sulfat ? (Ar Cu = 63,5; S = 32; O = 16)
A. 0,24 mol
B. 0,40 mol
C. 0,45 mol
D. 0,52 mol
E. 0,60 mol
JAWABAN BENAR
B.
0,40 mol
PEMBAHASAN
Tembaga (II) sulfat = CuSO4
Mr = 63,5 + 32 + 4(16)
Mr = 159,5
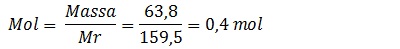
4.
Hitunglah jumlah partikel dari 3 gram grafit (C)! (Ar C = 12)
A. 2 x 1023
B. 2,5 x 1023
C. 15 x 1023
D. 6 x 1023
E. 15 x 1022
JAWABAN BENAR
E.
15 x 1022
PEMBAHASAN
Mol = gram/Ar
Mol = 3/12 = 0,25 mol
Jumlah partikel = mol x 6,02 x 1023
Jumlah partikel = 0,25 x 6,02 x 1023
Jumlah partikel = 15 x 1022
5.
Berapa gram massa 5,6 liter uap air pada keadaan STP ? (Ar H = 1, O = 16)
A. 4,5 gram
B. 4,8 gram
C. 5,0 gram
D. 6,0 gram
E. 7,2 gram
JAWABAN BENAR
A.
4,5 gram
PEMBAHASAN
Mol = volume/22,4
Mol = 5,6/22,4
Mol = 0,25
Gram = mol x Mr
Gram = 0,25 x 18
Gram = 4,5 gram

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

