Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Fisika
Teori Kinetik Gas
MATERI
Pengertian Gas Ideal

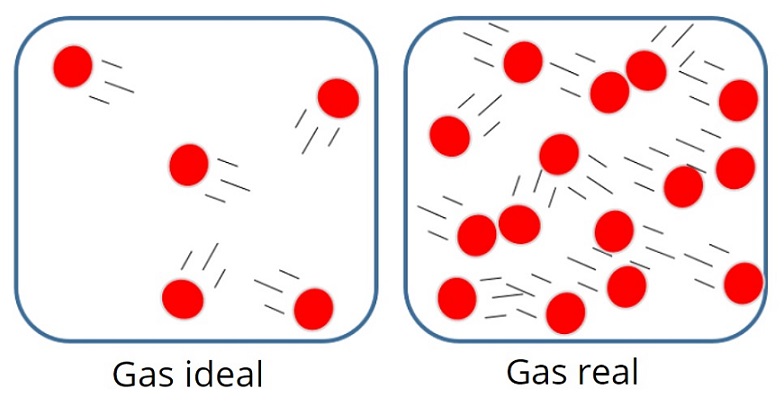
Gas sejati adalah gas nyata yang ada di sekitar kita. Contohnya yakni gas yang kita hirup, gas yang keluar dari kendaraan bermotor, dan sebagainya. Gas sejati memiliki sifat dan interaksi yang sangat kompleks.
Gambar 1. Ilustrasi Gas Ideal | Sumber : https://www.lifeder.com/gas-ideal/
Sementara itu, gas ideal adalah gas teoretik yang digunakan untuk mempelajari perilaku gas. Karena gas sejati bersifat kompleks, maka susah bagi kita untuk mempelajari perilakunya, Oleh karena itu, gas sejati ini disederhanakan menjadi gas ideal. Karena telah disederhanakan, gas ideal pun memiliki sifat dan interaksi yang lebih sederhana dibandingkan gas sejati. Jadi, sederhananya, gas ideal ini adalah model untuk perhitungan perilaku gas sejati atau gas nyata.
Adapun sifat-sifat gas ideal adalah sebagai berikut, sobat :
- Partikelnya berjumlah banyak.
- Tidak ada interaksi antarpartikel atau tidak ada gaya tarik menarik antarpartikelnya.
- Jika dibandingkan ukuran ruangan, ukuran partikel gas ideal bisa diabaikan.
- Tumbukan yang terjadi antara partikel gas dan dinding ruangan merupakan tumbukan lenting sempurna.
- Partikel gas tersebar secara merata di dalam ruangan.
- Partikel gas bergerak secara acak ke segala arah.
- Berlaku Hukum Newton tentang gerak.
- Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu mutlaknya.
Hukum Hukum dalam Gas Ideal

a) Hukum Boyle
Hukum Boyle menjelaskan hubungan antara tekanan dan volume gas pada suhu konstan.
Diasumsikan dalam silinder memiliki volume V1 dan tekanan P1. Jika piston ditekan hingga volume gas menjadi 1/2 V1 pada suhu konstan, tekanan gas akan bertambah menjadi 2P1. Jika piston ditekan hingga volume gas menjadi 1/4 V1 pada suhu konstan, tekanan gas akan bertambah menjadi 4P1. Penjelasan tersebut dapat dinyatakan dalam persamaan berikut:
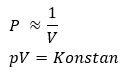
Sehingga,
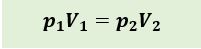
Keterangan :
p1: Tekanan mutlak mula mula gas dalam ruang tertutup (N/m3 atau Pa)
V1: Volume mula mula gas dalam ruang tertutup (m3 )
p2: Tekanan mutlak akhir gas dalam ruang tertutup (N/m3 atau Pa)
V2: Volume akhir gas dalam ruang tertutup (m3 )
Persamaan tersebut pertama kali dinyatakan oleh Robert Boyle pada tahun 1666 dan dinamakan hukum Boyle. Bunyi hukum Boyle yaitu, “pada sistem tertutup dan bersuhu konstan (isotermik), besar tekanan gas berbanding terbalik dengan besar volumenya”
b) Hukum Charles
Hukum Charles membahas hubungan antara volume dan suhu pada ruang tertutup. “Apabila tekanan gas yang berada di dalam suatu ruangan tertutup bersifat konstan, maka suhu mutlaknya akan berbanding lurus dengan volume gas tersebut.”. Anggap suhu dan volume mula-mula T1 dan V1 . Saat suhu dinaikkan menjadi 2T1 , volume gas menjadi 2V1 . Saat suhu dinaikkan menjadi 4T1, volume gas menjadi 4V1 . Penjabarannya dapat dituliskan dengan persamaan berikut.
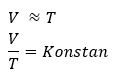
sehingga persamaan menjadi :
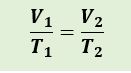
Keterangan :
T1: Suhu mutlak mula mula gas dalam ruang (K)
V1: Volume mula mula gas dalam ruang tertutup (m3)
T2:: Suhu mutlak akhir gas dalam ruang (K)
V2:: Volume akhir gas dalam ruang tertutup (m3)
c) Hukum Gay-Lussac
Hukum Gay-Lussac menjelaskan hubungan antara suhu dan tekanan gas pada volume konstan (isokhorik). Joseph Gay-Lussac menyimpulkan pada sistem dengan volume gas konstan, besarnya suhu mutlak gas sebanding dengan tekanannya. Pernyataan tersebut ditulis dalam persamaan berikut:
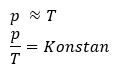
sehingga persamaan menjadi :
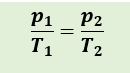
Keterangan :
T1: suhu mutlak mula mula gas dalam ruang (K)
T2: suhu mutlak akhir gas dalam ruang (K)
p1: tekanan mutlak mula mula gas dalam ruang tertutup (N/m3 atau Pa)
p2: tekanan mutlak akhir gas dalam ruang tertutup (N/m3 atau Pa)
Persamaan Umum Gas Ideal
2. Persamaan umum Gas Ideal
Setelah kita mempelajari materi sebelumnya tentang hukum Boyle, hukum Charles, dan hukum Gay-Lussac. Jika ketiga hukum disatukan, dikenal dengan persamaan umum gas ideal. Persamaannya dituliskan sebagai berikut.
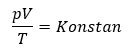
sehingga persamaan menjadi :
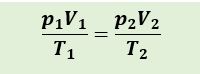
Keterangan :
T1= Suhu mutlak mula mula gas dalam ruang (K)
T2= Suhu mutlak akhir gas dalam ruang (K)
p1= Tekanan mutlak mula mula gas dalam ruang tertutup (N/m3 atau Pa)
p2= Tekanan mutlak akhir gas dalam ruang tertutup (N/m3 atau Pa)
V1= Volume mula mula gas dalam ruang tertutup (m3)
V2= Volume akhir gas dalam ruang tertutup (m3)
Persamaan gas ideal berlaku untuk gas dalam bejana tertutup dan diasumsikan tidak ada kebocoran sehingga massa gas tetap. Apabila sejumlah mol (n) gas diubah, persamaannya dituliskan sebagai berikut.

Keterangan :
p= Tekanan gas (N/m2 atau Pa)
V= Volume gas (m3)
n= jumlah mol gas
R= Tetapan umum (8,314J/mol K)
T= Suhu gas (K)
k= tetapan Blotzmann (1,38 x 10-23 J/K)
m= massa partikel gas (kg)
Mr= massa molekul relatif (kg/mol)
NA= bilangan Avogadro (6,02x10-23 partikel/mol)

Eksperimen

Judul percobaan : Mengamati fenomena pada hukum hukum gas ideal
Tujuan Percobaan :
Menyelidiki sifat- sifat gas ideal dalam ruang tertutup dan membuktikan persamaan gas ideal.
Link akses virtual laboratorium PhET simulation :
Simulasi Virtual Gas Ideal
Link akses Lembar Kerja Peserta Didik LKPD) :
LKPD Simulasi virtual Gas Ideal
Penerapan Persamaan umum gas ideal dalam kehidupan sehari hari

Penerapan Hukum-Hukum Gas Ideal pada Persoalan Fisika Sehari-hari
-
Ban kempes jika terparkir dalam waktu yang lama

Gambar 1. Ban Meletus | Sumber : kompasiana.com
Penyebab pertama adalah terparkir terlalu lama. Jika kendaraan Anda jarang dipakai dan berada di garasi dalam waktu yang lama besar kemungkinan ban kendaraan Anda menjadi kempes. Terlebih lagi jika terparkir dalam waktu lebih dari 1 minggu. Dalam ruang yang tertutup dan volume tetap, tekanan gas bisa sebanding dengan suhu gas. Hal tersebut bisa membuat tekanan menjadi lebih tinggi lagi.
Dalam ban mobil, saat suhu dingin penurunan suhu inilah yang menyebabkan tekanan ban menjadi menurun dan menyebabkan ban menjadi kempes. Tidak hanya itu saja, suhu dingin juga bisa membuat material karet mengalami pengerutan. Saat karet mengkerut, ruang kosong antara ban dan velg ini menjadi tercipta. Hal inilah yang menjadi penyebab udara yang ada di dalam ban keluar sendiri.
-
Gelembung pada Minuman Bersoda

Gambar 2. Gelembung Soda | Sumber : kompasiana.com
Pada minuman bersoda yang dituang ke dalam gelas, akan tampak adanya gelembung- gelembung udara. Gelembung tersebut merupakan inti molekul-molekul C02. Ketika minuman dituangkan, temperatur relatif tetap. Namun, tekanan hidrostatis minuman bersoda saat dituang di dalam gelas sedikit berubah. Oleh karena itu, gelembung yang naik dari dasar permukaan minuman semakin besar. -
Balon Udara Panas Dapat Mengudara

Gambar 3. Balon Udara | Sumber : detiknews.com
Balon udara bekerja berdasarkan pemuaian udara akibat pemanasan. Pemanasan pada balon dapat meningkatkan suhu udara dalam balon. Pemanasan tersebut juga menyebabkan volume dan tekanan gas berubah. Udara yang memuai menyebabkan massajenis udara dalam balon mengecil, nilainya lebih kecil dari massa jenis udara luar, akibatnya balon akan naik ke udara. -
Pelampung Kolam Renang

Gambar 4. Pelampung | Sumber : https://sainskimia.com/10-contoh-hukum-charle-dalam-kehidupan-sehari-hari/
Pelampung di kolam renang merupakan contoh nyata lainnya dari Hukum Charles. Kita mungkin telah mengamati bahwa setelah kita mengembang pelampung kolam dan mendorongnya ke dalam kolam, tampaknya pelampung itu sedikit kurang. Ini bukan karena adanya kebocoran pada pelampung. Namun hal ini terjadi karena suhu air di kolam rendah sehingga mengurangi volume udara di dalamnya. -
Sistem pernapasan manusia
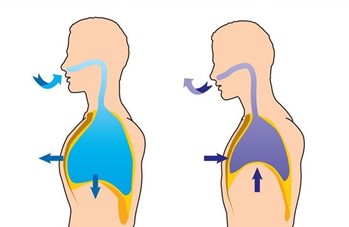
Gambar 5. sistem pernapasan manusia | Sumber : https://wikipedia.com
Ketika kita menarik napas, otot otot mengembangkan dinding dada dan menarik diafragma (otot otot besar dibawah dada) ke bawah, membuat paru paru yang elastis untuk mengembang. Paru paru yang mengembang ( volume udara bertambah ) menyebabkan tekanan di dalam paru paru kira kira 10 torr (1 torr= 1 mmHg) dibawah tekanan atmosfer. Tekanan di dalam paru paru yang lebih kecil daripada tekanan atmosfer menyebabkan udara dari luar memasuki paru paru. Ketika otot relaks, jaringan paru paru yang tadinya kencang karena ditarik diafragma ikut relaks. Diafragma bergerak ke atas dan paru paru mengempis. Paru paru yang mengempis menaikkan tekanan udara di dalam paru paru sehingga udara dari paru paru keluar.
Perlu diketahui dalam hal ini hanya ketika kita bernapas secara normal, otot otot tidak digunakan. Akan tetapi ketika kita melakukan olahraga berat seperti lari, otot otot ikut berperan untuk memaksa udara masuk dan keluar secara lebih cepat. Saat kita menarik napas, paru paru mengembang, volume membesar, dan tekanan udara dalam paru paru berada dibawah tekanan atmosfer. Saat menghembuskan napas, paru paru mengempis, volume mengecil, dan tekanan udara dalam paru paru meningkat.
Ayo Selidiki !

Menyelidiki pemerapan Gas Ideal

Gambar 1. Ban motor kempes | Sumber : suara.com
Mengapa ban sepeda motor kempes jika lama tidak digunakan ? coba perhatikan ban sepeda motor yang lama tidak digunakan, analisislah peristiwa itu dengan menghubungkan antara ban sepeda motor kempes dengan tidak digunakannya sepeda motor tersebut dalam waktu lama. Diskusikan jawaban pertanyaan pertanyaan berikut bersama teman sebangku anda.
- Mengapa ban sepeda motor dapat kempes?
- Apakah kasus tersebut menerapkan gas ideal?
- Apa hubungan antara suhu dengan tekanan dalam ban sepeda motor tersebut?
Jelaskan pendapatmu di fitur komentar !
1.
Jawablah pertanyaan berikut ini!
Sejumlah gas pada mulanya mempunyai tekanan P dan suhu T. Jika gas tersebut mengalami proses isokhorik sehingga tekanannyamenjadi 4 kali tekanan semula maka suhu gas berubah menjadi…
A. 1T
B. 2T
C. 3T
D. 4T
E. 5T
JAWABAN BENAR
D.
4T
PEMBAHASAN
Diketahui :
Tekanan awal (P1) = P
Tekanan akhir (P2) = 4P
Suhu awal (T1) = T
Ditanya : suhu akhir (T2)
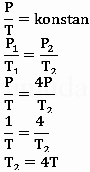
2.
Jawablah pertanyaan berikut ini!
Gas berada di dalam bejana tertutup pada mulanya bersuhu 27°C. Agar tekanannya menjadi 2 kali semula, maka suhu ruangan tersebut adalah….
A. 325°C
B. 326°C
C. 327°C
D. 328°C
E. 329°C
JAWABAN BENAR
C.
327°C
PEMBAHASAN
Diketahui :
Tekanan awal (P1) = P
Tekanan akhir (P2) = 2P
Suhu awal (T1) = 27°C + 273 = 300 K
Ditanya : suhu akhir (T2)

3.
Jawablah pertanyaan berikut ini!
Sejumlah gas ideal pada mulanya mempunyai tekanan P dan volume V. Jika gas tersebut mengalami proses isotermal sehingga tekanannya menjadi 4 kali tekanan semula maka volume gas berubah menjadi…
A. 1/5 v
B. 1/4 v
C. 1/3 v
D. 1/2 v
E. 1 v
JAWABAN BENAR
B.
1/4 v
PEMBAHASAN
Diketahui :
Tekanan awal (P1) = P
Tekanan akhir (P2) = 4P
Volume awal (V1) = V
Ditanya : volume akhir gas (V2)
Jawab :
Hukum Boyle (proses isotermal atau suhu konstan) :
P V = konstan
P1 V1 = P2 V2
(P)(V) = (4P)(V2)
V = 4 V2
V2 = V / 4 = ¼ V
Volume gas berubah menjadi ¼ kali volume awal
4.
Jawablah pertanyaan berikut ini!
Dalam suatu wadah tertutup, gas memuai sehingga volumenya berubah menjadi 2 kali volume awal (V = volume awal, P = tekanan awal). Tekanan gas berubah menjadi…
A. 1/6 P
B. 1/5 P
C. 1/4 P
D. 1/3 P
E. 1/2 P
JAWABAN BENAR
E.
1/2 P
PEMBAHASAN
Diketahui :
Tekanan awal (P1) = P
Volume awal (V1) = V
Volume akhir (V2) = 2V
Ditanya : tekanan akhir (P2)
Jawab :
P1 V1 = P2 V2
P V = P2 (2V)
P = P2 (2)
P2 = P / 2 = ½ P
Tekanan gas berubah menjadi ½ kali tekanan awal.
5.
Jawablah pertanyaan berikut ini!
Terdapat gas ideal menempati ruang tertutup yang volumenya 5x10-3 m3 pada temperatur 37⁰C. Bila tekanan gas dalam ruang itu 3000 N/m2. Berapakah jumlah mol gas tersebut?
A. 1,2 x 10-2 mol
B. 1,3 x 10-2 mol
C. 1,4 x 10-2 mol
D. 1,5 x 10-2 mol
E. 1,6 x 10-2mol
JAWABAN BENAR
A.
1,2 x 10-2 mol
PEMBAHASAN

6.
Kerjakan soal dibawah ini dengan tepat !
Gas ideal menempati ruangan dengan volume tetap Jika suhu dinaikkan menjadi 1,5 kali semula perbandingan tekanan awal dan tekanan akhir gas adalah….
A. 1 : 2
B. 2 : 1
C. 2 : 3
D. 3 : 4
E. 3 : 2
JAWABAN BENAR
C.
2 : 3
PEMBAHASAN
Proses isokorik
T2 = 1,5 T1
P1 : P2 = __?
Pada proses isokorik berlaku
P1 / T1 = P2 / T2
P1 / P2 = T1 / T2
P1 / P2 = T1 / (1,5 T1)
P1 / P2 = ⅔
P1: P2 = 2 : 3
7.
Perhatikan pernyataan berikut !
- Berlaku Hukum Newton
- Kelajuan dan gerak partikel tetap
- Selang waktu tumbukan sangat singkat
- Semua tumbukan partikel bersifat lenting tidak sempurna
Syarat suatu gas dikatakan ideal ditunjukan oleh nomor ….
A. 1) dan 2)
B. 1) dan 3)
C. 2) dan 3)
D. 2) dan 4)
E. 3) dan 4)
JAWABAN BENAR
B.
1) dan 3)
PEMBAHASAN
Sifat-sifat gas ideal adalah sebagai berikut.
- Partikelnya berjumlah banyak.
- Tidak ada interaksi antarpartikel atau tidak ada gaya tarik menarik antarpartikelnya.
- Jika dibandingkan ukuran ruangan, ukuran partikel gas ideal bisa diabaikan.
- Tumbukan yang terjadi antara partikel gas dan dinding ruangan merupakan tumbukan lenting sempurna.
- Partikel gas tersebar secara merata di dalam ruangan.
- Partikel gas bergerak secara acak ke segala arah.
- Berlaku Hukum Newton tentang gerak.
- Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu mutlaknya.
8.
Perhatikan soal dibawah ini !
Gas berada pada ruangan berukuran 1m x 2m x 3m. Ruangan saat itu memiliki suhu 27oC dan tekanan 1 atm. Jika 1 atm setara dengan 105 Pa, maka jumlah partikel pada ruangan tersebut adalah . . .
A. 1,4 x 1026
B. 1,6 x 1026
C. 1,8 x 1026
D. 2,0 x 1026
E. 2,4 x 1026
JAWABAN BENAR
A.
1,4 x 1026
PEMBAHASAN
Diketahui :
V = 6 m3
P = 1 atm = 105 Pa
T = 27oC = (27+273) = 300 K
k = 1,38 x 10-23 J/K
Ditanya : Jumlah partikel (N)
Jumlah partikel (N)
PV = N.k.T
6 x 105 = N (1,38 x 10-23)(300)
6 x 105 = N (4,14 x 10-21)
N = 1,4 x 1026
Jawaban A.
9.
Perhatikan soal dibawah ini !
Sejumlah gas ideal pada mulanya mempunyai tekanan P dan volume V. Jika gas tersebut mengalami proses isotermal sehingga tekanannya menjadi 4 kali tekanan semula maka volume gas berubah menjadi…
A. 4 kali volume awal
B. 2 kali volume awal
C. ½ kali volume awal
D. ¼ kali volume awal
E. ¾ kali volume awal
JAWABAN BENAR
D.
¼ kali volume awal
PEMBAHASAN
Hukum Boyle (proses isotermal atau suhu konstan) :
P V = konstan
P1 V1 = P2 V2
(P)(V) = (4P)(V2)
V = 4 V2
V2 = V / 4 = ¼ V
Volume gas berubah menjadi ¼ kali volume awal (D)
10.
Perhatikan soal dibawah ini !
Berikut ini merupakan contoh penerapan yang melibatkan hukum hukum gas ideal kecuali…
A. Ban meletus dibawah teriknya matahari
B. Gelembung pada minuman bersoda
C. Rel kereta yang memuai
D. Jarum suntik
E. Cat semprot
JAWABAN BENAR
C.
Rel kereta yang memuai
PEMBAHASAN
Ban meletus dibawah teriknya matahari, Gelembung pada minuman bersoda, Jarum suntik dan Cat semprot merupakan beberapa contoh penerapan yang didalamnya memuat hukum hukum gas ideal. Karena terdapat variabel variabel seperti suhu, tekanan, dan volume. Sedangkan rel kereta yang memuai merupakan contoh pemuaian pada benda, bukan gas ideal.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

