Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Fisika
Teori Kinetik Gas
MATERI
Tekanan Gas Ideal

1. Tekanan Gas Ideal
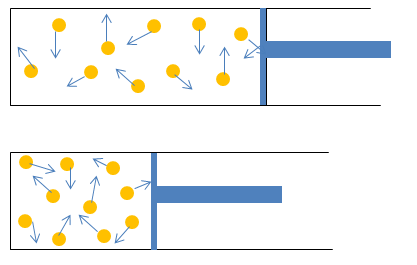
Gambar 1. Tekanan gas pada ruang tertutup | Sumber : http://andriyanilisah.weebly.com/
Keberadaan gas di ruang tertutup bisa mengakibatkan adanya tekanan. Tekanan tersebut disebabkan oleh adanya tumbukan antara partikel gas dan dinding tempat gas berada. Teori kinetik gas menjelaskan bahwa materi terdiri atas sejumlah besar molekul N bermassa m, yang bergerak dengan arah acak, dengan kecepatan bervariasi, serta melakukan tumbukan lenting sempurna satu sama lain dan terhadap dinding wadah.
Persamaan tekanan gas ideal dalam ruang tertutup adalah :
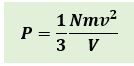
Keterangan :
P= Tekanan gas ideal (N/m2 )
N= Jumlah partikel
m= massa partikel gas (kg)
v= kecepatan rata rata partikel gas (m/s)
V= volume gas (m3)
Karena 1/2 mv2 adalah energi kinetik rata-rata dari partikel-partikel gas, maka persamaan diatas dapat dinyatakan sebagai berikut :
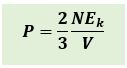

Contoh soal :
Di dalam sebuah bejana yang volumenya 100 cm3 terdapat 5 x 1021 partikel gas. Bila energi kinetik rata-rata translasi masing-masing partikel adalah 6 x 10-21 joule, maka hitunglah tekanan gas di dalam bejana tersebut !
Pembahasan :
V=100 cm3 =1×10-4 m3
N=5×1021 partikel
Ek=6×10-21 joule
P…?
Jawab :
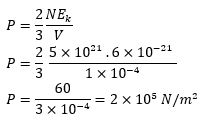
Sehingga, tekanannya adalah 2x105 N/m2
Hubungan antara Tekanan, Suhu, dan Energi Kinetik Gas

2. Suhu dan Energi pada Gas Ideal

Gambar 1. Balon Udara | Sumber : kompasiana.com
Taukah sobat ? Sebuah balon udara dapat terbang karena pemanas yang terdapat pada balon udara. Pemanasan tersebut mengakibatkan suhu udara di dalam balon meningkat dan memaksa sebagian udara keluar dari bagian bawah balon yang terbuka. Secara kuantitatif, suhu dan energi gas ideal dapat ditentukan sebagai berikut.
Berdasarkan persamaan gas ideal :
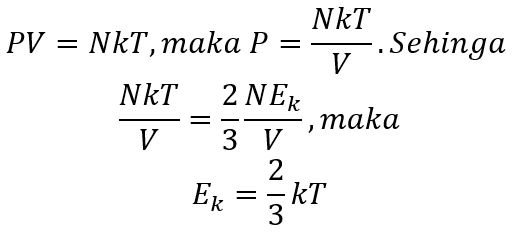
Keterangan :
Ek = Energi Kinetik rata rata (Joule)
k = konstanta Boltzman (1,38 × 10-23 J/K);
T = suhu gas (K);
N = jumlah partikel;
n = jumlah mol gas (mol); dan
R = tetapan gas ideal (8,314 J/mol.K).
Berdasarkan persamaan di atas, diperoleh persamaan untuk kecepatan efektif gas pada ruang tertutup. Adapun persamaan kecepatannya adalah sebagai berikut.
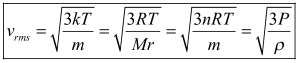
Keterangan :
vrms= kecepatan efektif gas ideal (m/s)
p (rho)= massa jenis gas (kg/m3 )
Contoh soal :
Sejumlah gas oksigen (Mr = 32 x 10-3 kg/mol) memiliki suhu mutlak empat kali dari sejumlah gas hidrogen (Mr = 2 x 10-3 kg/mol). Hitunglah perbandingan kecepatan efektif molekul hidrogen dan molekul oksigen !
Pembahasan :
Diketahui :
Mr O2=32 x 10-3
Mr H2=2 x 10-3
TO2=4TH2
Vrms H2 : Vrms O2?
Jawab :
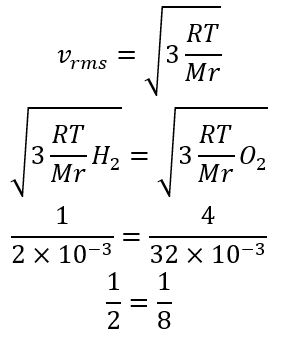
sehingga, perbandingan Vrms H2 : Vrms O2 adalah 8 : 2 atau 4 : 1
Teorema Ekipartisi Energi

3. Teorema ekipartisi energi
Teorema ekipartisi energi menyatakan bahwa masing-masing komponen kecepatan (kecepatan linear maupun kecepatan sudut), secara rata-rata memiliki energi kinetik per partikel/molekul yang berkaitan, sebesar 1/2 kT , atau setengah dari hasil konstanta Boltzmann dan suhu absolut (mutlak). Sementara itu, jumlah komponen kecepatan yang dibutuhkan untuk menjelaskan gerakan sebuah molekul secara lengkap disebut derajat kebebasan berkaitan dengan energi kinetik translasi, rotasi, vibrasi, dan energi potensial vibrasi. Secara matematis, teorema ekuipartisi energi dinyatakan sebagai berikut.
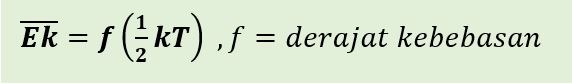
Pada gas monoatomik (beratom tunggal), molekul gas hanya melakukan gerak translasi. Oleh sebab itu, gas monoatomik memiliki tiga derajat kebebasan. Energi kinetik rata-rata total per molekul adalah;
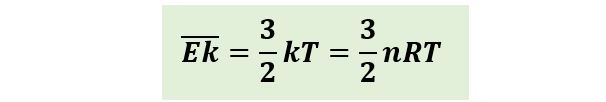
Sementara untuk gas diatomik, pada suhu kamar memiliki 5 derajat kebebasan dan mengalami gerak translasi dan rotasi. Energi kinetik rata-ratanya dinyatakan sebagai berikut;
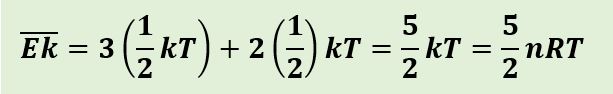
Sementara itu, bila pada gas diatomik bersuhu tinggi, memungkinkan molekul melakukan gerak translasi, rotasi, dan vibrasi dan memiliki tujuh derajat kebebasan
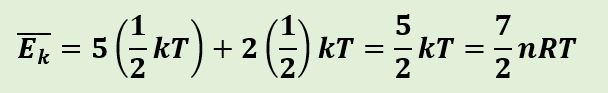
Energi Dalam

5. Energi Dalam
Energi dalam suatu sistem gas ideal didefinisikan sebagai jumlah energi kinetik translasi, rotasi, dan vibrasi seluruh molekul gas yang terdapat pada sistem tersebut. Jika di dalam suatu wadah terdapat N molekul gas, maka energi dalam dinyatakan:
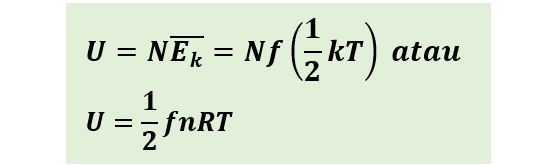
Keterangan :
U= energi dalam (J))
f= massa jenis gas (kg/m3 )
N= jumlah partikel
n= jumlah mol zat (mol)
k= konsanta Boltzmann (1,38x10-23 J/K)
T= suhu (K)
Ek= energi kinetik rata rata (J)
R= tetapan gas universal (8,31 J/mol K)
a. Energi Dalam Gas Monoatomik
Pada gas monoatomik, misalnya helium, neon, dan argon, nilai f = 3, sehingga energi dalam dinyatakan sebagai berikut;
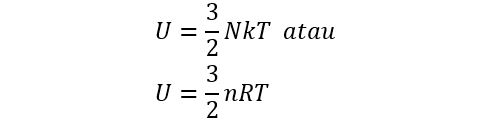
b. Energi Dalam Gas Diatomik
Pada gas diatomik, misalnya hidrogen, nitrogen, dan oksigen. Energi dalam pada gas diatomik dibagi menjadi 3 tingkatan berdasarkan suhunya, yaitu sebagai berikut;


Eksperimen

Judul percobaan : Energi Kinetik dan Kecepatan Rata-rata
Tujuan Percobaan : Menyelidiki hubungan antara suhu dengan sebaran energi kinetik dan kecepatan rata-rata partikel-partikel gas.
Link simulasi PhET : Simulasi PhET Teori Kinetik Gas
Link akses Lembar Kerja Peserta DIdik : LKPD Teori Kinetik Gas Subbab 2
1.
Jawablah pertanyaan berikut ini!
Apa yang dimaksud dengan energi dalam gas?
A. Gas yang terdiri atas partikel-partikel gas, setiap partikel tidak memiliki energi kinetik.
B. Gas terdiri atas partikel-partikel gas, setiap partikel memiliki energi kinetik.
C. Tidak ada gas
D. Gas terdiri atas partikel-partikel gas, setiap partikel memiliki volume
E. Gas terdiri atas partikel-partikel gas, setiap partikel memiliki massa jenis.
JAWABAN BENAR
B.
Gas terdiri atas partikel-partikel gas, setiap partikel memiliki energi kinetik.
PEMBAHASAN
Gas terdiri atas partikel-partikel gas, setiap partikel memiliki energi kinetik. Kumpulan dari energi kinetik dari partikel-partikel gas merupakan energi dalam gas.
2.
Jawablah pertanyaan berikut ini!
Persamaan P = Nmv2 /3V disubstitusikan dengan?
A. Persamaan massa jenis
B. Persamaan volume
C. Persamaan kecepatan
D. Persamaan energi kinetik
E. Persamaan massa
JAWABAN BENAR
D.
Persamaan energi kinetik
PEMBAHASAN
Persamaan P = Nmv2/ 3V dapat disubstitusi dengan persamaan energi kinetik
3.
Kerjakan soal dibawah ini dengan benar !
Dalam ruang tertutup terdapat gas dengan suhu 25oC. apabila gas dipanaskan sampai energi kinetiknya menjadi 6 kali semula, maka gas tersebut harus dipanaskan sampai suhu….
A. 150oC
B. 298oC
C. 890oC
D. 1.515oC
E. 1.778oC
JAWABAN BENAR
D.
1.515oC
PEMBAHASAN
Diketahui :
T1=25°C=298K
Ek 2=2x semula
T2…?
Jawab :

4.
Kerjakan Soal dibawah ini dengan benar !
Dalam ruangan berukuran 5m × 6m × 8m terdapat 20 mol gas O2 dengan energi kinetik rata rata 8×10-21 J. tekanan udara dalam ruangan tersebut adalah….
A. 10 Pa
B. 20 Pa
C. 30 Pa
D. 100 Pa
E. 200 Pa
JAWABAN BENAR
E.
200 Pa
PEMBAHASAN
Diketahui :
V=5×6×8=240 m3
n=20 mol
Ek=8×10-21 J
P…?
Jawab :
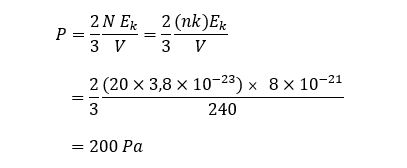
5.
Kerjakan soal dibawah ini dengan benar !
Energi dalam gas diatomik sebesar 12.471 J. jika suhu gas diatomik 127oC, banyaknya molekul gas tersebut adalah….
A. 3,02×1023 molekul
B. 5,12×1023 molekul
C. 8,28×1023 molekul
D. 1,012×1024 molekul
E. 1,505×1024 molekul
JAWABAN BENAR
E.
1,505×1024 molekul
PEMBAHASAN
Diketahui :
U=12.471 J
T=127°C=127+273=400K ( gas diatomik suhu rendah )
N…?
Jawab :
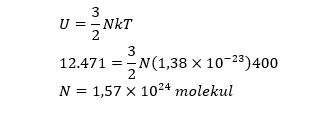
6.
Kerjakan soal dibawah ini dengan benar !
Energi dalam gas diatomik pada suhu 827oC sebesar 87.297 J. banyaknya mol pada gas tersebut adalah….
A. 2,73 mol
B. 3,13 mol
C. 4,27 mol
D. 5,13 mol
E. 6,28 mol
JAWABAN BENAR
A.
2,73 mol
PEMBAHASAN
Diketahui : gas diatomik
T=827° C=827° C+273=1100K suhu tinggi ; df=7
U=87,297 J
n…?
Jawab :
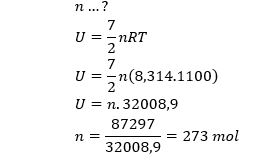
7.
Kerjakan soal ini dengan benar !
Suatu gas monoatomik mempunyai energi dalam 2,7x105 J. jika energi kinetik rata rata gas itu 3x10-21 J, jumlah zat gas monoatomik sebanyak… (NA=6x1023) molekul/mol)
A. 150 mol
B. 100 mol
C. 200 mol
D. 250 mol
E. 50 mol
JAWABAN BENAR
A.
150 mol
PEMBAHASAN
Diketahui :
U=2,7×105 J
Ek=3×10-21 J
NA=6×1023
n=⋯.?
Jawab :
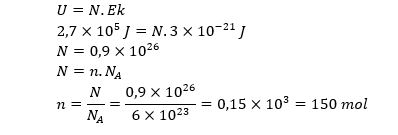
8.
Perhatikan pernyataan berikut ini !
P1 : Gas pada wadah tertutup merupakan gas ideal SEBAB
P2 : Gas tersebut bergerak lurus dan bebas dengan kelajuan tetap
Tanggapan terkait kedua pernyataan di atas adalah . . .
A. Kedua pernyataan benar dan saling berhubungan
B. Kedua pernyataan benar dan tidak saling berhubungan
C. Pernyataan 1 benar dan pernyataan 2 salah
D. Pernyataan 1 salah dan pernyataan 2 benar
JAWABAN BENAR
D.
Pernyataan 1 salah dan pernyataan 2 benar
PEMBAHASAN
Gas ideal adalah gas yang memiliki partikel sama besar dan identik, kelajuan konstan dan bergerak lurus, ia berinteraksi antar partikel atau dinding dengan tumbukan lenting sempurna dengan kata lain partikel gas berbelok arah setelah bertumbukan. Selain itu, pada gas ideal berlaku hukum Newton.
9.
Perhatikan pernyataan dibawah ini !
Suatu bejana kokoh yang berisi gas ideal dikocok berulang ulang. Manakah pernyataan yang benar tentang keadaan gas tersebut setelah dikocok ?
A. Temperatur gas bertambah meskipun energi dalamnya tetap
B. Temperatur gas bertambah tanpa gas melakukan usaha
C. Energi dalam gas berkurang karena sebagian berubah menjadi kalor
D. Gas melakukan usaha sebesar penambahan energi dalamnya
E. Temperatur gas bertambah sebanding dengan penambahan kelajuan molekul gas
JAWABAN BENAR
E.
Temperatur gas bertambah sebanding dengan penambahan kelajuan molekul gas
PEMBAHASAN
Pv=NRT persamaan gas ideal
1/2mv2=3/2kt rumus energi kinetik molekul gas monoatomik
Jika dikocok maka kecepatan bertambah, lalu temperatur naik juga karena berbanding lurus, dan gas melakukan usaha karena ketika tempratur naik, gas akan memuai sehingga volume nya akan meningkat
W=P.DeltaV (rumus usaha gas)
10.
Jawablah pertanyaan berikut ini!
Sebuah tabung bervolume 590 liter berisi gas oksigen pada suhu 20ºC dan tekanan 5 atm. Tentukan massa oksigen dalam tangki ! (Mr oksigen = 32 kg/kmol)
A. 2,453 kg
B. 3,913 kg
C. 4,235 kg
D. 4,913 kg
E. 5,235 kg
JAWABAN BENAR
B.
3,913 kg
PEMBAHASAN
Diketahui :
V = 5,9 . 10-1 m3
P = 5 . 1,01 . 105 Pa
T = 20ºC = 293 K
Ditanyakan :
m = ….?
Jawaban :
PV = nRT dan n = M / Mr sehingga :
PV = mRT / Mr
m = PVMr / RT
= 5. 1,01 . 105 .0,59 . 32 / 8,314 . 293
= 3,913 kg

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

