Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Hukum Termokimia
MATERI
Jenis-jenis Perubahan Entalpi

Jenis-jenis Perubahan Entalpi
- Perubahan Entalpi Pembentukan Standar
Perubahan entalpi yang terjadi pada pembentukan 1 mol senyawa dari unsur-unsurnya pada suhu dan tekanan standar (25oC, 1 atm).
Contoh:
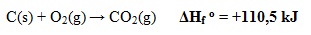
- Perubahan Entalpi Penguraian Standar
Perubahan entalpi yang terjadi pada penguraian 1 mol senyawa menjadi unsur-unsur penyusunnya pada keadaan standar. Perubahan entalpi yang terjadi pada penguraian 1 mol senyawa menjadi unsur-unsur penyusunnya pada keadaan standar.
Contoh:
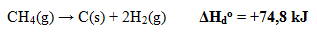
- Perubahan Entalpi Pembakaran Standar
Perubahan entalpi yang terjadi pada pembakaran 1 mol suatu zat secara sempurna pada keadaan standar.
Contoh:
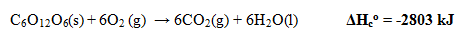
- Perubahan Entalpi Netralisasi Standar
Perubahan entalpi yang terjadi pada penetralan 1 mol asam oleh basa atau 1 mol basa oleh asam pada keadaan standar.
Contoh:
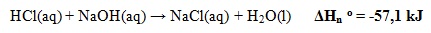
- Perubahan Entalpi Penguapan Standar
Perubahan entalpi yang terjadi pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada keadaan standar.
Contoh:

- Perubahan Entalpi Peleburan Standar
Perubahan entalpi yang terjadi pada pencairan / peleburan 1 mol zat dalam fase padat menjadi zat dalam fase cair pada keadaan standar.
Contoh:
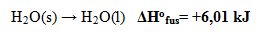
- Perubahan Entalpi Pelarutan Standar
Perubahan entalpi yang terjadi ketika 1 mol zat melarut dalam suatu pelarut (umumnya air) pada keadaan standar.
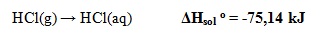
- Perubahan Entalpi Pengatoman Standar
Perubahan entalpi yang terjadi ketika 1 mol suatu senyawa menjadi atom-atomnya dalam bentuk gas pada keadaan standar.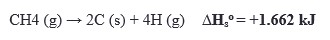
Penentuan Perubahan Entalpi Reaksi

Penentuan Perubahan Entalpi Reaksi
- Penentuan perubahan entalpi reaksi menggunakan cara Kalorimetri
Kalorimetri adalah cara penentuan energi kalor reaksi dengan kalorimeter.
Kalorimeter adalah sistem terisolasi, sehingga semua energi yang dibutuhkan atau dibebaskan tetap berada dalam kalorimeter. Dengan mengukur perubahan suhu, kita dapat menentukan jumlah energi kalor reaksi dan entalpi reaksi:
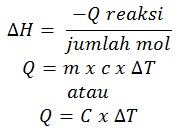

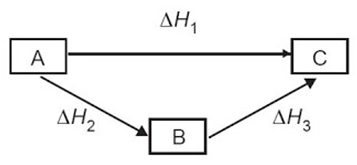
- Penentuan perubahan entalpi reaksi menggunakan Hukum Hess
Pada tahun 1840, G.H. Hess melakukan penelitian bahwa perubahan entalpi reaksi yang tidak dapat ditentukan dengan cara kalorimeter dapat ditentukan dengan perhitungan.
Hukum Hess berbunyi bahwa perubahan entalpi reaksi hanya bergantung pada keadaan awal dan keadaan akhir, tidak bergantung pada jalannya reaksi.
Untuk menentukan besarnya perubahan entalpi reaksi harus menjumlahkan persamaan dari perubahan entalpi masing-masing reaksi.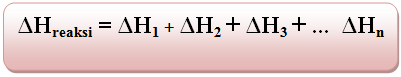
Dapat digambarkan secara skematis:
- Menentukan perubahan entalpi Reaksi berdasarkan Data Energi Ikatan
Pada molekul diatom, energi ikatan disebut juga energi disosiasi, dilambangkan dengan D (dissociation). Energi ikatan didefinisikan sebagai jumlah energi yang diperlukan untuk memutuskan ikatan 1 mol suatu molekul dalam wujud gas pada suhu dan tekanan yang tetap.
Untuk memutuskan ikatan diperlukan energi. Sebaliknya, untuk membentuk ikatan dilepaskan energi. Selisih energi pemutusan dan pembentukan ikatan menyatakan perubahan entalpi reaksi tersebut, yang dirumuskan sebagai berikut:

1.
Jawablah soal berikut ini!
"Perubahan entalpi reaksi hanya bergantung pada keadaan awal dan keadaan akhir, tidak bergantung pada jalannya reaksi" merupakan definisi dari hukum...
A. hukum Hess
B. hukum Faraday I
C. hukum Faraday II
D. hukum Newton I
E. hukum Newton II
JAWABAN BENAR
A.
hukum Hess
PEMBAHASAN
Hukum Hess berbunyi perubahan entalpi reaksi hanya bergantung pada keadaan awal dan keadaan akhir, tidak bergantung pada jalannya reaksi.
2.
Jawablah soal berikut ini!
Perubahan entalpi yang terjadi pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada keadaan standar. adalah definisi dari ....
A. entalpi pembentukan standar
B. entalpi pembakaran standar
C. entalpi penguraian standar
D. entalpi penguapan standar
E. entropi
JAWABAN BENAR
D.
entalpi penguapan standar
PEMBAHASAN
Entalpi penguapan standar adalah perubahan entalpi yang terjadi pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada keadaan standar.
3.
Jawablah soal berikut ini!
Persamaan termokimia berikut ini merupakan perubahan entalpi pembentukan standar, kecuali....
A. C(s) + 2Cl2(g) --> CCl4(l), delta Hf = -134 kJ
B. Ca(s) + Cl2(g) --> CaCl2(s), delta Hf = -795,8 kJ
C. C6H12O6(s) + 6O2(g) --> 6CO2(g) + H2O(g), delta Hc = -2803 kJ
D. Na(s) + 1/2H2(g) + C(s) + 3/2O2(g) --> NaHCO3(s), delta Hf = -947,7 kJ
E. Zn(s) + 1/2O2(g) --> ZnO(s), delta Hf = -348 kJ
JAWABAN BENAR
C.
C6H12O6(s) + 6O2(g) --> 6CO2(g) + H2O(g), delta Hc = -2803 kJ
PEMBAHASAN
C6H12O6(s) + 6O2(g) --> 6CO2(g) + H2O(g)
delta Hc = -2803 kJ
Merupakan entalpi pembakaran standar.
4.
Jawablah soal berikut ini!
Diagram tingkat energi pembentukan gas SO3 sebagai berikut:
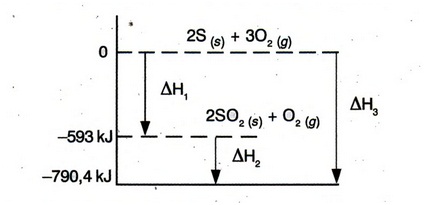
Nilai perubahan entalpi kedua pada diagram tersebut adalah....
A. 790,4 kJ
B. 593,8 kJ
C. 196,6 kJ
D. -196,6 kJ
E. -593,8 kJ
JAWABAN BENAR
D.
-196,6 kJ
PEMBAHASAN
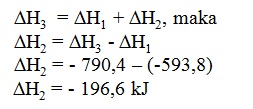
5.
Jawablah soal berikut ini!
Data energi ikatan :
C - C = 349 kJ/mol
C - O = 361 kJ/mol
C - H = 416 kJ/mol
O - H = 466 kJ/mol
Maka, energi pengikatan dari etanol adalah ....
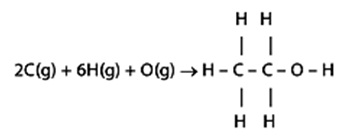
A. 1,59 x 103 kJ/mol
B. 2,01 x 103 kJ/mol
C. 2,84 x 103 kJ/mol
D. 3,26 x 103 kJ/mol
E. 4,01 x 103 kJ/mol
JAWABAN BENAR
D.
3,26 x 103 kJ/mol
PEMBAHASAN
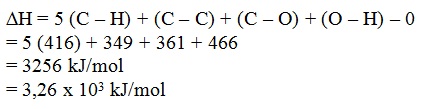
6.
Jawablah soal berikut ini!
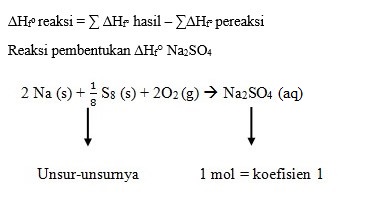
Perubahan entalpi dari reaksi manakah yang berikut ini dapat disebut dengan perubahan entalpi pembentukan delta Hfo Na2SO4 kristal….
A. 2NaOH(aq) + H2SO4(aq) --> Na2SO4(aq) + 2H2O(l)
B. 2NaOH(s) + H2SO4(aq) --> Na2SO4(aq) + 2H2O(l)
C. Na2O(s) + SO2(g) --> Na2SO4(aq)
D. 2Na(s) + S8(s) + 2O2(g) --> Na2SO4(aq)
E. 16Na(s) + S8(s) + 16O2(g) --> 8Na2SO4(aq)
JAWABAN BENAR
D.
2Na(s) + S8(s) + 2O2(g) --> Na2SO4(aq)
PEMBAHASAN
Perubahan entalpi pembentukan standar merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan stabil, pada 25°C dan tekanan 1 atm. Perubahan entalpi pembentukan standar suatu zat ditentukan dengan menggunakan rumus:
7.
Jawablah soal berikut ini!
Diantara persamaan termokimia di bawah ini yang merupakan perubahan entalpi penguraian adalah….
A.

B.
C.

D.

E.
JAWABAN BENAR
A.

PEMBAHASAN
Perubahan entalpi penguraian standar adalah perubahan entalpi yang terjadi pada penguraian 1 mol suatu senyawa menjadi unsur-unsurnya yang paling stabil pada keadaan standar.
Pada dasarnya, perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tandanya. Jadi dari pilihan ganda yang di atas, jawaban yang tepat adalah A karena reaktannya berupa satu mol menjadi unsur-unsurnya.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

