Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Laju Reaksi
MATERI
Hukum Laju Reaksi

Hukum laju reaksi adalah persamaan yang menghubungkan laju reaksi dengan konstanta laju dan konsentrasi reaktan. Salah satu cara untuk mengkaji pengaruh konsentrasi reaktan terhadap laju reaksi ialah dengan menentukan bagaimana laju awal bergantung pada konsentrasi awal.
Pengukuran laju secara percobaan nantinya akan menghasilkan hukum laju untuk reaksi yang menyatakan laju dalam konstanta laju dan konsentrasi reaktan. Ketergantungan laju pada konsentrasi menghasilkan orde reaksi.
Konstanta laju reaksi atau tetapan laju reaksi adalah tetapan yang harganya bergantung pada jenis pereaksi, suhu dan katalis.
Suatu reaksi dapat dinyatakan berorde nol jika laju tidak bergantung pada konsentrasi reaktan dan berorde pertama jika lajunya bergantung pada konsentrasi reaktan dipangkatkan satu. Selain orde nol dan satu, juga terdapat orde yang lebih tinggi dan orde pecahan.
Satu ciri penting dari laju reaksi ialah waktu yang diperlukan untuk menurunkan konsentrasi suatu reaktan menjadi setengah dari konsentrasi awalnya, atau biasa disebut waktu paruh. Untuk reaksi orde pertama, waktu paruh tidak bergantung pada konsentrasi awal.
Secara umum untuk reaksi :
Keterangan :
v = Laju reaksi (M.det-1)
k = Tetapan Laju Reaksi
m = Tingkat reaksi (orde reaksi) terhadap A
n = Tingkat reaksi (orde reaksi) terhadap B
[A]= Konsentrasi awal A
[B]= Konsentrasi awal B
Orde Reaksi

Orde Reaksi
Pangkat perubahan konsentrasi terhadap perubahan laju disebut orde reaksi
- Ada reaksi berorde 0, dimana tidak terjadi perubahan laju reaksi berapapun perubahan konsentrasi pereaksi. Pada orde reaksi nol, laju reaksi tidak dipengaruhi oleh konsentrasi zat (konstan). Laju reaksinya sama dengan tetapan laju reaksi (k). Grafiknya adalah sebagai berikut:
- Ada reaksi berorde 1, dimana perubahan konsentrasi pereaksi 2 kali menyebabkan laju reaksi lebih cepat 2 kali. Pada orde reaksi satu, pertambahan laju reaksi sama dengan perubahan konsentrasi zat. Apabila konsentrasi reaktan reaksi orde satu dikali faktor n, maka nilai laju reaksinya adalah n1 lebih besar. Grafiknya adalah sebagai berikut:
- Ada reaksi berorde 2, dimana laju perubahan konsentrasi pereaksi 2 kali menyebabkan laju reaksi lebih cepat 4 kali, dst. Apabila konsentrasi reaktan reaksi orde satu dikali faktor n, maka nilai laju reaksinya adalah n2 lebih besar. Grafiknya adalah sebagai berikut:
Orde Reaksi Total adalah penjumlahan orde reaksi seluruh zat reaktan.
Contoh:

Langkah-langkah penentuan orde reaksi adalah sebagai berikut.
- Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama.
- Bandingkan 2 data percobaan tersebut dengan memasukkannya ke dalam persamaan umum laju reaksi.
Contoh:
Pada reaksi 2NO + Br2 --> 2NOBr diperoleh data reaksi sebagai berikut:
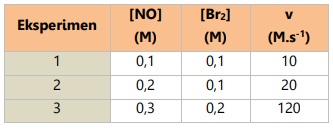
Tentukan orde reaksi dari NO!
Jawab:
Untuk mencari orde reaksi NO, gunakan data eksperimen yang memuat konsentrasi Br2 dengan nilai tetap (eksperimen 1 dan 2).
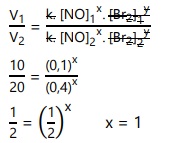
1.
Jawablah soal berikut ini!
Persamaan laju dari reaksi aA --> bB dapat dituliskan:
Dari eksperimen diperoleh data sebagai berikut:
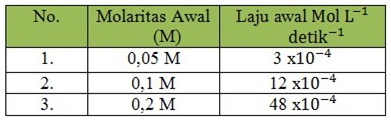
Tentukan orde pada reaksi tersebut!
A. 1
B. 2
C. 3
D. 4
E. 5
JAWABAN BENAR
B.
2
PEMBAHASAN
Orde reaksi dapat dicari dengan cara membandingkan laju reaksi dari masing-masing.

2.
Jawablah soal berikut ini!
Gas A dan gas B bereaksi menurut persamaan berikut:
A(g) + B(g) --> C(g) + D(g)
Pengaruh konsentrasi A dan B terhadap laju reaksi ditemukan sebagai berikut:
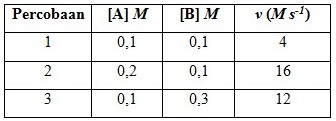
Orde reaksi terhadap A adalah....
A. 1
B. 2
C. 3
D. 4
E. 5
JAWABAN BENAR
B.
2
PEMBAHASAN
Untuk menentukan orde reaksi A maka [B] harus tetap, karena itu diambil data percobaan 1 dan 2.
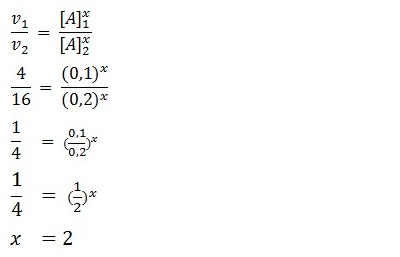
3.
Jawablah soal berikut ini!
Pada reaksi P + Q --> P2Q diketahui bahwa reaksi berorde satu terhadap konsentrasi Q. Hubungan laju reaksi awal zat Q ditunjukkan oleh grafik....
A.

B.

C.

D.

E.

JAWABAN BENAR
D.

PEMBAHASAN
Suatu reaksi dikatakan berorde satu terhadap suatu pereaksi apabila laju reaksi berbanding lurus dengan konsentrasi pereaksi tersebut.
4.
Jawablah soal berikut ini!
Untuk reaksi A + B --> AB diperoleh data sebagai berikut.
Jika konsentrasi A dinaikkan tiga kali pada konsentrasi B tetap, laju reaksi menjadi sembilan kali lebih cepat. Jika konsentrasi A dan B dinaikkan tiga kali, laju reaksi menjadi 27 kali lebih cepat. Persamaan laju reaksinya adalah....
A. v = k [A]2 [B]
B. v = k [A] [B]2
C. v = k [A] [B]
D. v = k [A]2 [B]2
E. v = k [A]
JAWABAN BENAR
A.
v = k [A]2 [B]
PEMBAHASAN

5.
Jawablah soal berikut ini!
Suatu reaksi A + B hasil reaksi, persamaan laju reaksinya v = k [A]2 [B]2. Bila pada suhu tetap konsentrasi A dan B masing-masing dua kali dari semula, laju reaksi adalah....
A. tidak berubah
B. empat kali lebih besar
C. delapan kali lebih besar
D. enam belas lebih besar
E. dua kali lebih besar
JAWABAN BENAR
D.
enam belas lebih besar
PEMBAHASAN
Misal pada kondisi mula-mula konsentrasi A adalah a dan konsentrasi B adalah b dan laju reaksinya adalah vo. nilai va dapat ditentukan melalui perbandingan.

6.
Jawablah soal berikut ini!
Jika pada reaksi 3/2N2 + 3/2H2 --> NH3, kecepatan reaksi berdasarkan N2 dinyatakan sebagai xN dan berdasarkan H2 dinyatakan sebagai xH maka persamaan yang tepat adalah….
A. xN = xH
B. xN = 1/2 xH
C. xN = 1/3 xH
D. xN = 3/2 xH
E. xN = 3 xH
JAWABAN BENAR
A.
xN = xH
PEMBAHASAN

7.
Jawablah soal berikut ini!
Suatu reaksi berlangsung dua kali lebih cepat setiap suhunya dinaikkan 10oC. Jika laju reaksi pada saat suhu 20oC adalah x M/detik, tentukan laju reaksi pada saat suhu dinaikkan menjadi 60oC...
A. 2x
B. 4x
C. 8x
D. 16x
E. 32x
JAWABAN BENAR
D.
16x
PEMBAHASAN
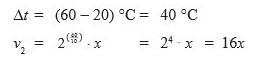

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

