Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Laju Reaksi
MATERI
Teori Tumbukan

Reaksi kimia dapat berlangsung apabila terjadi tumbukan antarmolekul.
Teori tumbukan adalah teori yang menjelaskan pengaruh faktor terhadap laju reaksi.
Menurut teori tumbukan, suatu reaksi berlangsung sebagai hasil tumbukan antar partikel pereaksi yang memiliki energi cukup dan arah tumbukan yang tepat.
Berdasarkan teori tumbukan, laju reaksi akan bergantung pada tiga hal utama berikut:
- Frekuensi tumbukan
- Energi partikel reaktan
- Arah tumbukan
Energi aktivasi/pengaktifan (Ea) adalah energi minimum yang harus dimiliki reaktan, yang digunakan untuk mengaktifkan kemampuan reaksi sehingga reaktan dapat bereaksi.
Teori tumbukan dan energi aktivasi berguna untuk menjelaskan faktor-faktor yang mempengaruhi laju reaksi. Laju suatu reaksi kimia dapat dipercepat dengan cara memperbesar harga energi kinetik molekul atau menurunkan harga energi aktivasi.
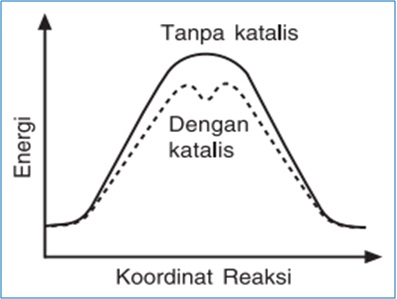
Jika digambarkan dalam grafik adalah sebagai berikut:
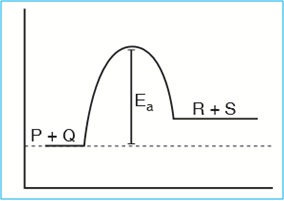
Makna energi aktivasi:
- Jika bernilai rendah, berarti reaksi dapat terjadi pada suhu rendah.
- Jika bernilai tinggi, berarti reaksi dapat terjadi pada suhu tinggi
Faktor-faktor yang Mempengaruhi Laju Reaksi

Berhubungan dengan Teori Tumbukan dan Energi Aktifasi, terdapat beberapa faktor yang dapat mempengaruhi laju reaksi, yaitu:
Konsentrasi
Semakin besar konsentrasi --> semakin banyak jumlah partikel pereaksi --> tumbukan efektif semakin banyak terjadi --> reaksi berlangsung semakin cepat.
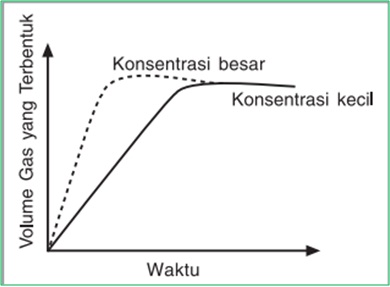
Luas Permukaan Bidang Sentuh
Luas permukaan zat semakin besar --> singgungan antarpereaksi semakin besar --> tumbukan efektif semakin banyak --> laju reaksi meningkat.
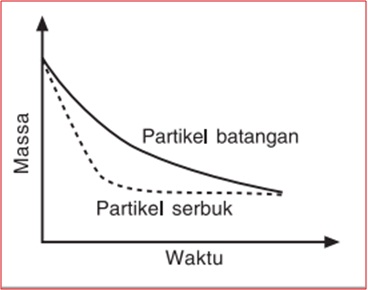
Suhu
Suhu dinaikkan --> energi kinetik pereaksi bertambah --> gerakan semakin acak dan cepat --> tumbukan efektif semakin banyak terjadi --> reaksi berlangsung semakin cepat.
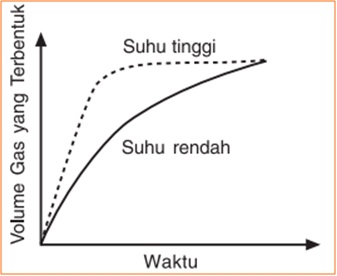
Katalis
Katalis dapat mempercepat laju reaksi tanpa ikut bereaksi, yaitu dengan menurunkan energi aktifasi (Ea).
1.
Jawablah soal berikut ini!
Kenaikan suhu akan mempengaruhi laju reaksi sebab....
A. kenaikan suhu akan mengakibatkan turunnya energi aktivasi
B. Energi kinetik partikel-partikel yang bereaksi meningkat
C. dalam reaksi kimia, suhu berperan seperti katalis
D. kenaikan suhu menyebabkan konsentrasi pereaksi meningkat
E. menyebabkan frekuensi antar partikel semakin meningkat
JAWABAN BENAR
B.
Energi kinetik partikel-partikel yang bereaksi meningkat
PEMBAHASAN
Pada suhu tinggi, partikel-partikel yang terdapat pada suatu zat akan bergerak lebih cepat dari pada suhu rendah. Oleh karena itu, apabila terjadi kenaikan suhu, partikel-partikel akan bergerak lebih cepat, sehingga energi partikel meningkat.
2.
Jawablah soal berikut ini!
Suatu katalis mempercepat reaksi dengan cara meningkatkan....
A. jumlah tumbukan molekul
B. energi kinetik molekul
C. perubahan entalpi
D. energi aktivasi
E. jumlah molekul yang memiliki energi di atas energi aktivasi
JAWABAN BENAR
E.
jumlah molekul yang memiliki energi di atas energi aktivasi
PEMBAHASAN
Jumlah molekul yang memiliki energi di atas energi aktivasi dan menurunkan energi aktivasi sehingga reaksi dapat terjadi lebih cepat.
3.
Jawablah soal berikut ini!
Reaksi antara logam magnesium dengan larutan HCl adalah sebagai berikut.
Mg(s) + 2HCl(aq) --> MgCl2(aq) + H2(g)
- Meningkatkan konsentrasi larutan HCl
- Meningkatkan suhu reaksi
- Menggunakan pita magnesium
- Menghilangkan gas hidrogen hasil reaksi
Dari perlakuan di atas yang dapat meningkatkan tumbukan antara pereaksi adalah....
A. 1 dan 2
B. 3 dan 4
C. 1, 2, dan 3
D. 2, 3, dan 4
E. 1, 2, 3, dan 4
JAWABAN BENAR
A.
1 dan 2
PEMBAHASAN
Meningkatkan konsentrasi reaksi dapat mempercepat reaksi, meningkatkan suhu reaksi juga dapat mempercepat reaksi.
4.
Jawablah soal berikut ini!
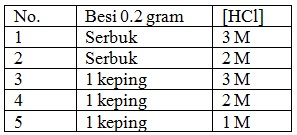
Pada percobaan 1 dan 3 faktor yang berpengaruh terhadap jalannya reaksi adalah....
A. konsentrasi HCl
B. sifat-sifat
C. suhu
D. katalis
E. luas permukaan
JAWABAN BENAR
E.
luas permukaan
PEMBAHASAN

Pada percobaan nomor 1, besi 0,2 gram yang digunakan berbentuk serbuk, sedangkan pada percobaan nomor 3, besi 0,2 gram yang digunakan berbentuk kepingan. Hal itu menandakan bahwa meski konsentrasi HCl yang digunakan sama, yaitu 3 M, terdapat perbedaan pada luas permukaan besi 0,2 gram yang digunakan.
5.
Jawablah soal berikut ini!
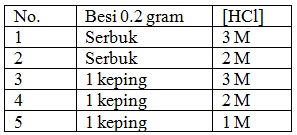
Dari percobaan di bawah, reaksi yang paling cepat berlangsung adalah....
A. 1
B. 2
C. 3
D. 4
E. 5
JAWABAN BENAR
A.
1
PEMBAHASAN
Pada percobaan 1, yang digunakan adalah serbuk besi 0,2 gram dan larutan HCl 3 M. bentuk serbuk dapat memperbesar luas permukaan dan konsentrasi HCl yang tinggi juga dapat mempercepat reaksi berlangsung.
6.
Jawablah soal berikut ini!
Energi aktivasi suatu reaksi dapat diperkecil dengan cara….
A. menaikkan suhu
B. menambah konsentrasi
C. menghaluskan pereaksi
D. memperbesar tekanan
E. menambahkan katalis
JAWABAN BENAR
E.
menambahkan katalis
PEMBAHASAN
Luas permukaan, semakin luas permukaan semakin cepat reaksi terjadi.
Suhu, semakin tinggi suhu semakin cepat reaksi terjadi karena energi kinetiknya bertambah melebihi energi aktivasi .
Konsentrasi, semakin besar konsentrasi, semakin cepat terjadi reaksi karena semakin banyak molekul-molekul bertumbukan (berinteraksi)
Katalis, berfungsi mempercepat terjadinya reaksi karena katalis dapat menurunkan energi aktivasi.
7.
Jawablah soal berikut ini!
Uap bensin lebih mudah terbakar daripada bensin cair. Perbedaan tersebut disebabkan karena faktor….
A. entalpi
B. katalisator
C. suhu
D. luas permukaan
E. konsentrasi
JAWABAN BENAR
D.
luas permukaan
PEMBAHASAN
Luas permukaan pada uap bensin lebih besar daripada bensin cair. Jadi uap bensin lebih mudah terbakar dibandingkan bensin cair.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

