Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Fisika
Termodinamika
MATERI
Hukum I termodinamika (Kekekalan Energi dalam Sistem)

Termodinamika mempunyai hukum-hukum pendukungnya. Hukum-hukum ini menerangkan bagaimana dan apa saja konsep yang harus diperhatikan seperti peristiwa perpindahan panas dan kerja pada proses termodinamika.
Sejak perumusannya, hukum-hukum ini sudah menjadi hukum penting dalam dunia fisika yang berhubungan dengan termodinamika. Penerapan hukum-hukum ini juga digunakan dalam berbagai bidang seperti bidang ilmu lingkungan, otomotif, ilmu pangan, ilmu kimia dan lain-lain.
Energi tidak bisa diciptakan maupun dimusnahkan. Manusia hanya bisa mengubah bentuk energi dari bentuk energi satu ke energi lainnya. Dalam termodinamika, jika sesuatu diberikan kalor, maka kalor tersebut akan berguna untuk usaha luar dan mengubah energi dalam.
Bunyi Hukum I Termodinamika
“Untuk setiap proses apabila kalor Q diberikan kepada sistem dan sistem melakukan usaha W, maka akan terjadi perubahan energi dalam ”.
U = Q - W
Dimana U menunjukkan sifat dari sebuah sistem, sedangkan W dan Q tidak. W dan Q bukan fungsi variabel keadaan, tetapi termasuk dalam proses termodinamika yang bisa merubah keadaan. U merupakan fungsi variabel keadaan (P, V, T, n).
W bertanda positif bila sistem melakukan usaha terhadap lingkungan dan negatif jika menerima usaha lingkungan.
Q bertanda positif jika sistem menerima kalor dari lingkungan dan negatif jika melepas kalor pada lingkungan.
Perubahan energi dari sebuah sistem hanya tergantung pada transfer panas ke dalam sistem dan kerja yang dilakukan oleh sistem dan tidak bergantung pada proses yang terjadi. Pada hukum ini tidak ada petunjuk adanya arah perubahan dan batasan-batasan lain.
1. Rumus Hukum Termodinamika I
Secara matematis hukum I termodinamika dapat dirumuskan sebagai berikut:
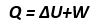
Dengan ketentuan, jika:
Q(+) -> sistem menerima kalor
OR -> sistem melepas kalor
W(+) -> sistem melakukan usaha
W(-) -> sistem dikenai usaha
U(+) -> terjadi penambahan energi dalam
U(-) -> terjadi penurunan energi dalam
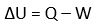
2. Proses-proses
Isobaris -> tekanan tetap
Isotermis -> suhu tetap -> U= 0
Isokhoris -> volume tetap (atau isovolumis atau isometric) -> W = 0
Adiabatis -> tidak terjadi pertukaran kalor -> Q = 0
Siklus -> daur -> U = 0
3. Persamaan Keadaan Gas
a. Hukum Gay-Lussac
Tekanan tetap -> V/T = Konstan -> V1/T1 = V2/T2
b. Hukum Charles
Volume tetap -> P/T = Konstan -> P1/T1 = P2/T2
c. Hukum Boyle
Suhu tetap -> PV = Konstan -> P1V1 = P2V2
P, V, T Berubah (non adiabatis)
(P1V1) / (T1) = (P2V2) / (T2)
d. Adiabatis
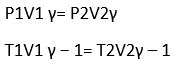
y = perbandingan kalor jenis gas pada tekanan tetap dan volum tetap
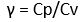
e. Usaha
W=PV -> Isobaris
W = 0 -> Isokhoris
W = nRT ln (V2 / V1) -> Isotermis
W = -3/2 nRT-> Adiabatis ( gas monoatomik)
Keterangan :
T = suhu (Kelvin, jangan Celcius)
P = tekanan (Pa = N/m2)
V = volume (m3)
n = jumlah mol
1 liter = 10-3m3
1 atm = 105 Pa
f. Mesin Carnot
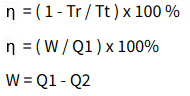

Hukum II termodinamika (Arah reaksi sistem dan batasan)

Hukum kedua ini membatasi perubahan energi mana yang bisa terjadi dan yang tidak. Pembatasan ini dinyatakan dengan berbagai cara, yaitu :
“Hukum II termodinamika dalam menyatakan aliran kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya”
a. Hukum II termodinamika dalam pernyataan tentang mesin kalor :
Tidak mungkin membuat suatu mesin kalor yang bekerja dalam suatu siklus yang semata-mata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar.
b. Hukum II termodinamika dalam pernyataan entropi (besaran termodinamika yang menyertai suatu perubahan setiap keadaan dari awal sampai akhir sistem dan menyatakan ketidakteraturan suatu sistem) :
Total entropi semesta tidak berubah ketika proses reversibel terjadi dan bertambah ketika proses irreversible terjadi.
Hukum III termodinamika

Hukum ketiga termodinamika terkait dengan temperatur nol absolut.
Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut (temperatur Kelvin) semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum.
Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
1.
Jawablah pertanyaan berikut!
1,5 m3 gas helium yang bersuhu 27oC dipanaskan secara isobarik sampai 87oC. Jika tekanan gas helium 2 x 105 N/m2 , gas helium melakukan usaha luar sebesar....
A. 20 kJ
B. 40 kJ
C. 60 kJ
D. 80 kJ
E. 100 kJ
JAWABAN BENAR
C.
60 kJ
PEMBAHASAN

2.
Kerjakan soal berikut ini dengan tepat!
2000/693 mol gas helium pada suhu tetap 27 derajat C mengalami perubahan volume dari 2,5 liter menjadi 5 liter. Jika R = 8,314 J/mol K dan ln 2 = 0,693 tentukan usaha yang dilakukan gas helium!
A. 3678,4 joule
B. 4988,4 joule
C. 5788,2 joule
D. 6954,2 joule
E. 7896,4 joule
JAWABAN BENAR
B.
4988,4 joule
PEMBAHASAN
W = nRT ln (V2 / V1) W = (2000/693 mol) ( 8,314 J/mol K)(300 K) ln ( 5 L / 2,5 L ) W = (2000/693) (8,314) (300) (0,693) = 4988,4 joule
3.
Kerjakan soal berikut ini dengan tepat!
Terdapat 5 liter gas bertekanan 3 atm sehingga volumenya mengembang dengan tekanan konstan sampai mencapai 10 liter. Berapakah usaha yang dilakukan oleh gas ?
A. 3 atm.liter
B. 5 atm.liter
C. 7 atm.liter
D. 10 atm.liter
E. 12 atm.liter
JAWABAN BENAR
D.
10 atm.liter
PEMBAHASAN
Diketahui :
V1 = 5 liter
P = 3 atm
V2 = 10 liter
Usaha pada tekanan konstan :
W = PV
W = 2 (10-5)
W = 2 (5) = 10 atm.liter
4.
Kerjakan soal berikut ini dengan tepat!
Pada sebuah sistem yang terdiri atas 4 kg air dengan suhu 73 derajat C, 30 kJ usaha dilakukan dengan cara mengaduknya dan 10 kkal pans dibuang. Berapakah perubahan tenaga internal sistem ?
A. -11,8 kJ
B. -15,8 kJ
C. -20,4 kJ
D. -22,8 kJ
E. -25,3 kJ
JAWABAN BENAR
A.
-11,8 kJ
PEMBAHASAN
Diketahui :
m = 4 kg
T = 73oC = 346 K
Usaha yang dilakukan
W = -30kJ,
sedangkan kalor yang keluar = -10kkal = 10 x 4,18 kJ= 41,8 kJ
Sehingga tenaga internal pada sistem adalah :
U = Q - W
U = -41,8 kJ + 30 kJ = -11,8 kJ
5.
Kerjakan soal berikut ini dengan tepat!
Terdapat sebuah mesin panas yang menyerap panas 400 J dari tandon panas, kemudian melakukan usaha dan membuang 200 J panas ketandon dingin. Besar efisiensi mesin tersebut?
A. 25 %
B. 50 %
C. 60 %
D. 75 %
E. 90 %
JAWABAN BENAR
B.
50 %
PEMBAHASAN
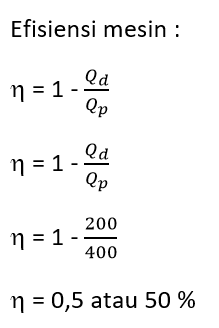

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

