Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Hukum Dasar Kimia, Konsep Mol, dan Stoikiometri
MATERI
Hukum Kekekalan Massa (Hukum Lavoisier)


Hukum Lavoisier menyatakan kekekalan massa pada reaksi.
"Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi adalah tetap."
Dalam hal ini, berarti suatu zat yang mengalami reaksi kimia tidak berubah massa. Oleh karena itu, reaktan memiliki massa yang sama dengan produk yang dihasilkannya. Pada reaksi kimia, terjadi perubahan warna, suhu, pembentukan gas dan endapan.
Contoh:
jika kita mereaksikan hidrogen 4 gram dan oksigen 32 gram, menghasilkan hidrogen oksida 36 gram (14 + 32 = 36).
Hukum Perbandingan Tetap (Hukum Proust)


Hukum Proust menyatakan perbandingan massa pada reaksi.
"Perbandingan massa unsur-unsur pembentuk suatu senyawa selalu tetap."
Suatu zat yang direaksikan akan selalu memiliki perbandingan yang sama untuk membentuk suatu senyawa.
Contoh:
Fe2+ dengan S2- dalam membentuk FeS, perbandingan keduanya berturut-turut selalu 7 : 4. Jadi, dalam pembentukan FeS, apabila terdapat Fe sejumlah 7 gram, sudah pasti terdapat S sejumlah 4 gram, berlaku kelipatannya.
Hukum Kelipatan Perbandingan (Hukum Dalton)


Hukum Dalton menjelaskan bahwa dua unsur atau lebih dapat membentuk lebih dari satu senyawa yang berbeda.
"Bila dua unsur dapat membentuk dua senyawa atau lebih, unsur pertama massanya tetap, unsur kedua akan menghasilkan suatu perbandingan bilangan bulat sederhana."
Contoh:
Dalam senyawa NO, perbandingan massa nitrogen dan massa oksigen yaitu 7 : 8. Dalam senyawa N2O, perbandingan massa nitrogen dan massa oksigen yaitu 14 : 8, sedangkan dalam NO2 yaitu 7 : 16. Perbandingan massa oksigen dalam NO dan massa oksigen dalam N2O memiliki nilai yang sama yaitu 8, sedangkan perbandingan massa nitrogen dalam NO dan nitrogen dalam N2O berbeda.
Dapat disimpulkan bahwa perbandingan massa NI dan NII yaitu 7 : 14 = 1 : 2.
Hukum Perbandingan Volume (Hukum Gay Lussac)


Hukum Gay-Lussac menyatakan per-bandingan volume atom-atom pada gas.
"Pada suhu dan tekanan yang sama, volume gas-gas yang terlibat dalam reaksi berbandingan sebagai bilangan bulat sederhana."
Perbandingan volume gas pada kedua hukum ini merupakan koefisien dari reaksi tersebut.
Contoh:
Jika 20 L nitrogen direaksikan dengan hidrogen sesuai reaksi berikut,
N2 + 3H2 --> 2NH3
Perbandingan koefisien reaksinya 1 : 3 : 2, dan volumenya pun memiliki perbandingan sama, jadi volume H2 60 L, dan volume NH3 40 L.
1. Hukum Lavoisier menyatakan bahwa jumlah ....
A. partikel zat-zat sebelum dan sesudah reaksi
sama
B. molekul zat-zat sebelum dan sesudah reaksi
sama
C. zat-zat sebelum dan sesudah reaksi sama
D. volume zat-zat sebelum dan sesudah reaksi
sama
E. massa zat-zat sebelum dan sesudah reaksi
sama
JAWABAN BENAR
E.
massa zat-zat sebelum dan sesudah reaksi sama
PEMBAHASAN
Pada seriap reaksi kimia, massa zat-zat yang bereaksi adalh sama dengan massa produk reaksi
2.
Jawablah soal berikut ini!
Hukum yang menyatakan bahwa suatu senyawa kimia selalu memiliki susunan perbandingan yang tetap adalah hukum ....
A. Avogadro
B. Gay Lussac
C. Proust
D. Dalton
E. Lavoisier
JAWABAN BENAR
C.
Proust
PEMBAHASAN
Pada setiap reaksi, massa zat yang bereaksi dengan sejumlah tertentu zat lain selalu tetap, dalam suatu senyawa murni selalu terdiri atas unsur-unsur sama yang tergabung dalam perbandingan tertentu merupakan hukum perbandingan tetap Proust.
3.
Kerjakan soal berikut ini dengan tepat!
Sejumlah logam besi dipijarkan dengan 3,2 gram belerang menghasilkan 8,8 gram senyawa besi(II) sulfida. Berapa gram logam besi yang telah bereaksi ?
A. 3,4 gram
B. 5,6 gram
C. 5,8 gram
D. 6,0 gram
E. 8,2 gram
JAWABAN BENAR
B.
5,6 gram
PEMBAHASAN
Reaksi:
Fe (x gr) + S (3,2 gr) --> FeS (8,8 gr)
Menurut hukum kekekalan massa:
Massa sebelum bereaksi = Massa sesudah bereaksi
(x + 3,2) gr = 8,8 gr
x = (8,8-3,2) gr = 5,6 gram
4.
Kerjakan soal berikut ini dengan tepat!
Bila logam magnesium dibakar dengan gas oksigen akan diperoleh senyawa magnesium oksida. Hasil percobaan tertera pada tabel berikut:
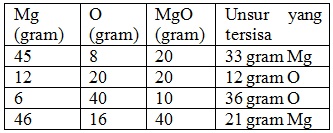
Berapa perbandingan massa magnesium dan oksigen di dalam senyawa magnesium oksida ?
A. 1 : 2
B. 2 : 3
C. 3 : 2
D. 4 : 1
E. 3 : 1
JAWABAN BENAR
C.
3 : 2
PEMBAHASAN
Ambil data percobaan 1
Massa magnesium yang bereaksi = (45 – 33)gr = 12 gr
Maka perbandingan massa Mg : O = 12 : 8 = 3 : 2
5.
Kerjakan soal berikut ini dengan tepat!
Unsur A dan unsur B dapat membentuk 3 senyawa. Jika kadar massa A di dalam senyawa I = 15%, pada senyawa II = 30%, dan pada senyawa III = 45%; hitunglah perbandingan massa B di dalam ketiga senyawa tersebut untuk massa A tetap!
A. 3 : 2 : 1
B. 2 : 5 : 3
C. 2 : 1 : 5
D. 5 : 1 : 2
E. 5 : 2 : 1
JAWABAN BENAR
E.
5 : 2 : 1
PEMBAHASAN
Jika dimisalkan 100% = 100 gram
Terdapat 3 senyawa
- Senyawa 1 --> A : B = 15 % : (100 – 15)%
= 15 : 85 = 3 : 17 = 9 : 51 - Senyawa 2 --> A : B = 30% : (100 – 30)%
= 30 : 70 = 3 : 7 = 9 : 21 - Senyawa 3 --> A : B = 45% : (100 – 45)%
= 45 : 55 = 9 : 11 = 9 : 11
jadi perbandingan B untuk A tetap adalah
= 51 : 21 : 11
= 5 : 2 : 1

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

