Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Ikatan Kimia
MATERI
Ikatan Ion

Ikatan ion adalah ikatan yang terjadi:
- Berdasarkan serah terima/perpindahan elektron.
- Antara ion positif dan ion negatif.
- Antara unsur logam dan non-logam.
- Antara unsur golongan IA dan IIA (+) dan golongan VIA dan VIIA (-).
Contoh senyawa ion antara lain: NaCl, MgCl2, CaCl2, KOH, KCl, dll.
Pembentukan Ikatan Ion
Ikatan ion terjadi karena atom-atom yang mempunyai energi ionisasi rendah (mudah melepas elektron) akan melepaskan elektronnya dan membentuk ion positif. Elektron yang dilepas akan ditangkap oleh atom yang mempunyai afinitas elektron besar (mudah menarik elektron) untuk membentuk ion negatif. Selanjutnya ion positif dan negatif akan saling Tarik menarik dengan gaya elektrostatis membentuk senyawa yang tidak bermuatan (netral). Sebagai contoh pembentukan ikatan ion pada NaCl sebagai berikut.
Berdasarkan kaidah oktet, untuk mencapai kestabilannya, atom Na harus melepaskan 1 elektron, sedangkan atom Cl membutuhkan 1 elektron. Atom Na akan bermuatan positif, sedangkan atom Cl akan bermuatan negatif. Dengan demikian, atom Na dan Cl dapat mencapai kestabilannya dengan cara serah terima elektron. Atom Na menyerahkan 1 elektron kepada atom Cl sehingga atom Cl menerima 1 elektron dari atom Na.
Karena berbeda muatan, ion Na+ dan ion Cl- akan saling tarik-menarik. Interaksi yang dinamakan interaksi elektrostatik ini berlangsung secara terus menerus. Reaksi pembentukannya digambarkan sebagai berikut:
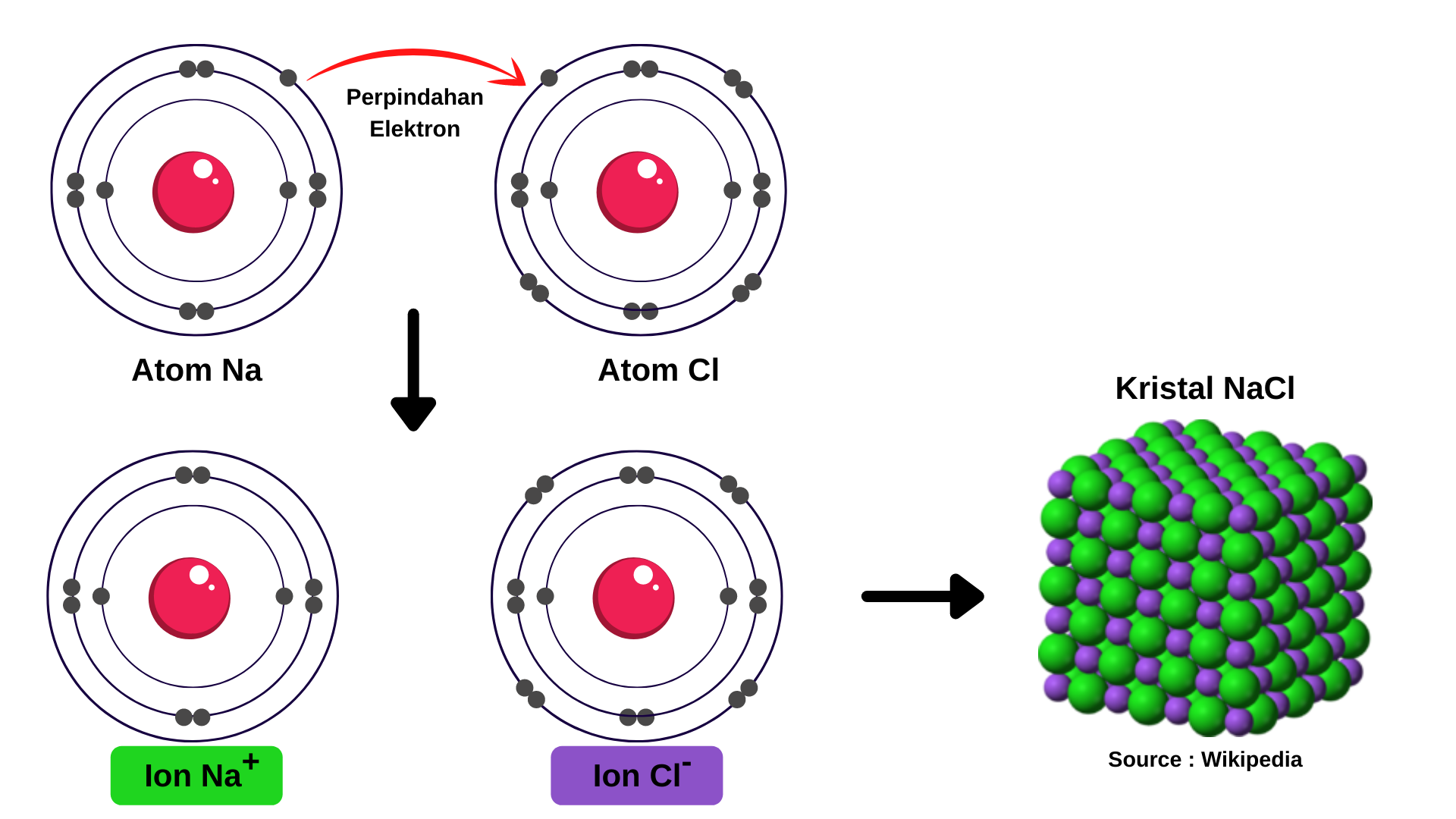
Senyawa yang terbentuk melalui ikatan ion disebut senyawa ion.
Sifat-sifat Senyawa Ion antara lain:
- Kristalnya keras tetapi rapuh.
- Mempunyai titik lebur dan titik didih yang tinggi.
- Mudah larut dalam air.
- Dapat menghantarkan arus listrik.
Ikatan Kovalen

Ikatan Kovalen adalah ikatan yang terjadi:
- Berdasarkan pemakaian pasangan elektron bersama.
- Antara unsur non-logam dan non-logam.
- Ikatan kovalen terdiri dari tiga jenis: ikatan kovalen tunggal, ikatan kovalen rangkap, ikatan kovalen koordinat.
Ikatan kovalen dituliskan menggunakan struktur Lewis dan rumus bangun/struktur molekul.
- Struktur Lewis (rumus elektron)
Rumus Lewis menggambarkan bagaimana keadaan elektron-elektron valensi atom-atom saling berpasangan dan saling berikatan membentuk ikatan kovalen untuk memenuhi kaidah oktet. - Rumus bangun (struktur molekul)
Rumus bangun menggambarkan bagaimana cara ikatan kovalen yang digunakan atom-atom.
Garis satu ( - ) melambangkan ikatan kovalen biasa.
Garis dua ( = ) atau tiga ( = ) melambangkan ikatan kovalen rangkap.
Tanda panah (-->) melambangkan ikatan kovalen koordinat.
Contoh senyawa kovalen antara lain: H2O, HF, HCl, CO2, NH3, Cl2, I2, Br2, O2, dll.
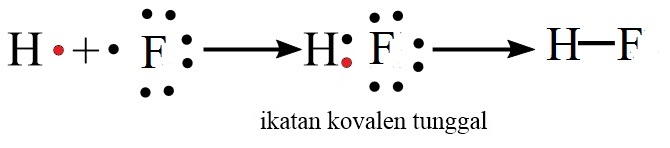
Ikatan Kovalen Tunggal
Ikatan kovalen tunggal adalah ikatan kovalen yang jumlah pemakaian elektron bersamanya adalah satu pasang.
Contoh:
Ikatan Kovalen Rangkap
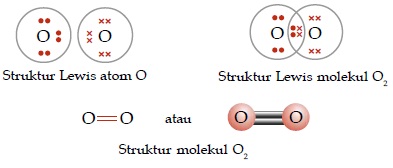
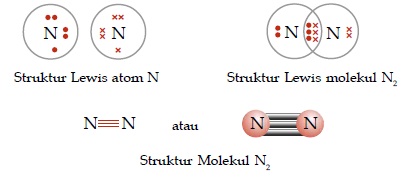
Ikatan kovalen rangkap adalah ikatan kovalen yang jumlah pemakaian elektron bersamanya lebih dari satu pasang.
Contoh:
- Ikatan kovalen rangkap dua
- Ikatan kovalen rangkap tiga
Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen yang pemakaian elektron bersamanya hanya berasal dari satu atom.
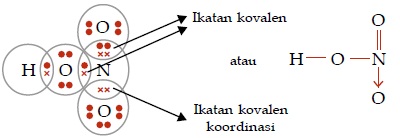
Kepolaran Senyawa Kovalen

Kepolaran senyawa adalah perilaku suatu zat yang menyerupai medan magnet, yaitu terdapat kutub sementara yang disebut dipol. Kepolaran dipengaruhi oleh perbedaan keelektronegatifan yang besar (0,5 – 2,0) dan bentuk molekul dari senyawa kovalen tersebut.
Kepolaran senyawa terdapat pada senyawa kovalen, dan dibagi menjadi dua, yaitu:
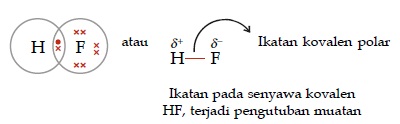
- Senyawa kovalen polar
Adalah senyawa kovalen yang dibentuk oleh dua atau lebih unsur berbeda, dimana keelektronegatifan pasti berbeda, sehingga menghasilkan dipol atau terjadi pengutuban atau polarisasi muatan. Ciri yang lain dapat dilihat dari struktur molekul senyawa yang asimetris dan atom pusatnya memiliki pasangan elektron bebas (PEB).
Contoh: HF, HCl, HBr, HI, H2O.
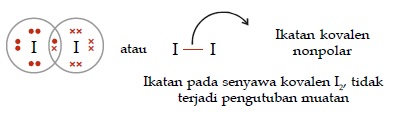
- Senyawa kovalen non-polar
Adalah senyawa kovalen yang dibentuk oleh dua atau lebih unsur sama, dimana keelektronegatifan pasti sama. Oleh karena itu, tidak terjadi pengutuban atau polarisasi muatan. Ciri yang lain dapat dilihat dari struktur molekul senyawa yang simetris atom pusatnya tidak memiliki pasangan elektron bebas (PEB).
Contoh: H2, I2, Cl2, O2, N2, dan senyawa poliatomik lainnya.
Tingkat kepolaran senyawa dinyatakan dalam momen dipol dalam satuan Coulomb meter. Senyawa non-polar memiliki momen dipol nol.
Perbedaan Ikatan Ion dengan Ikatan Kovalen

Senyawa ionik dan kovalen memiliki beberapa perbedaan sifat, antara lain:
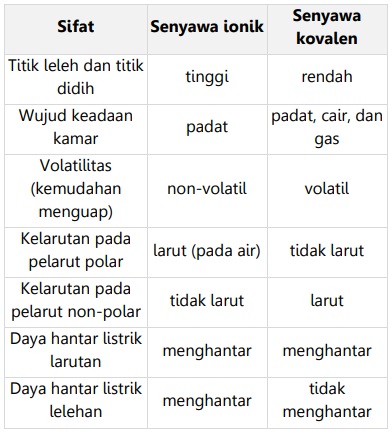
Ikatan Logam

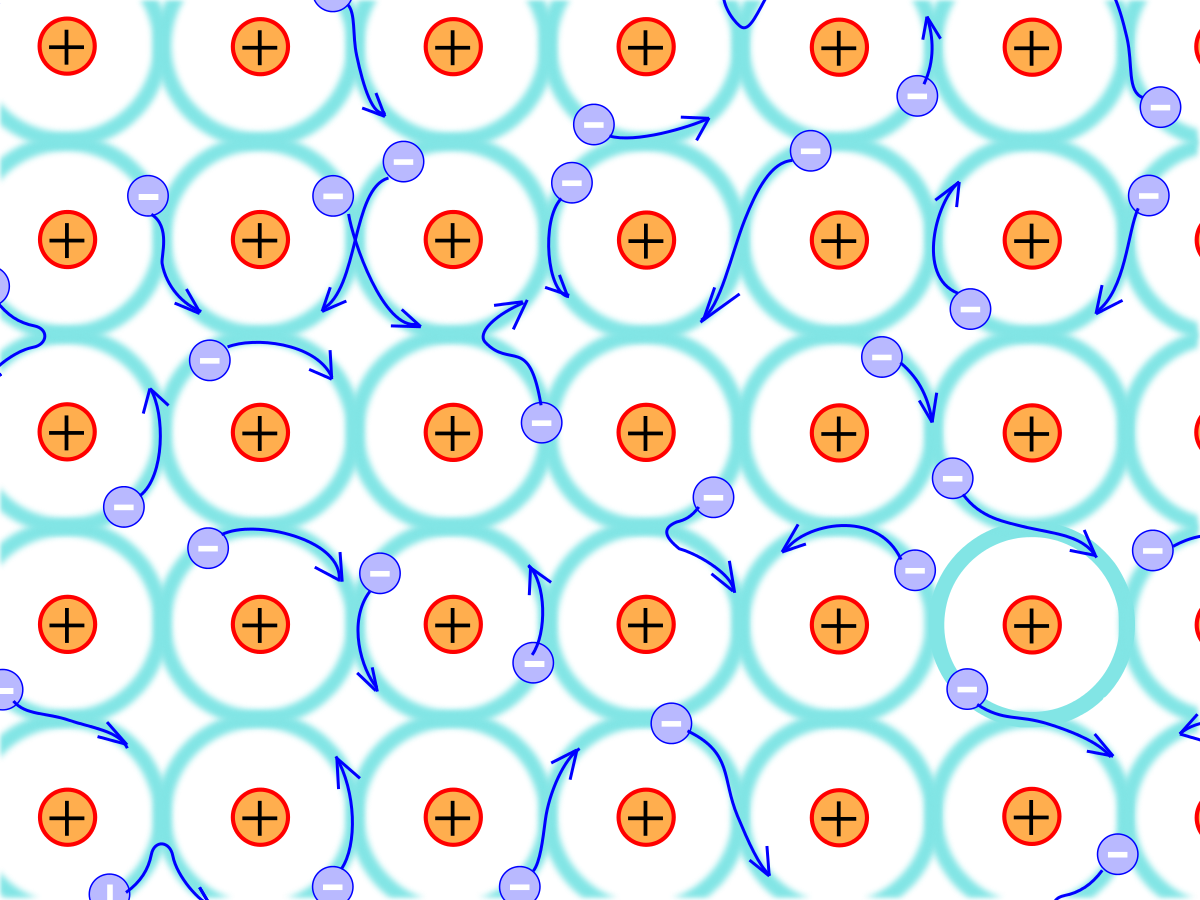
Ikatan logam adalah ikatan yang terjadi:
- Antar atom-atom unsur logam.
- Antara elektron valensi logam yang membentuk lautan valensi.
Unsur logam kulit terluarnya relatif longgar, karena memiliki sedikit elektron valensi. Elektron valensi tersebut mengalami delokalisasi.
Delokalisasi adalah keadaan dimana posisi elektron tidak tetap dan berpindah-pindah, sehingga berbaur menyerupai awan/lautan valensi.
Awan/lautan valensi tersebut bertindak sebagai perekat atom logam yang saling tarik-menarik dan berdekatan satu sama lain.
Ikatan logam digambarkan sebagai berikut:
Ikatan logam menjadikan logam memiliki sifat:
- Keras namun lentur.
- Tidak mudah patah meski ditempa.
- Titik leleh dan titik didih yang tinggi.
- Konduktor listrik dan panas yang baik
1.
Kerjakan soal berikut ini dengan tepat!
Unsur 9Y berikatan dengan unsur 19K membentuk suatu senyawa. Rumus molekul dan jenis ikatan yang terbentuk secara berurutan adalah....
A. KY - Ionik
B. KY - Kovalen
C. KY2 - Kovalen
D. K2Y - Ionik
E. K2Y - Kovalen
JAWABAN BENAR
A.
KY - Ionik
PEMBAHASAN
9Y = 2,7 : (golongan VIIA) non-logam
19K = 2,8,8,1 : (golongan IA) logam
Unsur K dan Y membentuk ikatan ionik dengan rumus molekul KY
2.
Kerjakan soal berikut ini dengan tepat!
Suatu ikatan antar atom logam yang memiliki keteraturan dan simetris dalam penyusunan elektronnya, elektron valensinya membentuk lautan valensi. Sehingga membuat keterkaitan yang kuat juga dapat menyebabkan logam menghantarkan listrik. merupakan definisi dari.....
A. ikatan ion
B. ikatan hidrogen
C. ikatan koordinasi
D. ikatan logam
E. ikatan kovalen
JAWABAN BENAR
D.
ikatan logam
PEMBAHASAN
Ikatan Logam adalah ikatan antar atom logam yang memiliki keteraturan dan simetris dalam penyusunan elektronnya, elektron valensinya membentuk lautan valensi. Sehingga membuat keterkaitan yang kuat juga dapat menyebabkan logam menghantarkan listrik.
3.
Kerjakan soal berikut ini dengan tepat!
Ikatan yang terjadi dimana pasangan elektron yang digunakan bersama berasal dari salah satu atom, sedangkan yang lain hanya menyediakan tempat disebut ikatan ....
A. ion
B. kovalen
C. kovalen koordinasi
D. kovalen rangkap
E. semipolar
JAWABAN BENAR
C.
kovalen koordinasi
PEMBAHASAN
Ikatan kovalen koordinasi adalah ikatan yang terjadi dimana pasangan elektron yang digunakan bersama berasal dari salah satu atom.
4.
Kerjakan soal berikut ini dengan tepat!
Jika unsur 15G berikatan dengan 17Cl, maka rumus senyawa dan jenis ikatan yang terjadi berturut-turut adalah....
A. G2Cl – ionik
B. G2Cl3 – ionik
C. GCl – kovalen
D. GCl2 – kovalen
E. GCl3 – kovalen
JAWABAN BENAR
E.
GCl3 – kovalen
PEMBAHASAN
15G = 2, 8, 5 membutuhkan 3 elektron untuk stabil
17Cl = 2, 8, 7 membutuhkan 1 elektron untuk stabil
Ikatan antara unsur non-logam membentuk ikatan kovalen dengan rumus molekul GCl3.
5.
Kerjakan soal berikut ini dengan tepat!
Senyawa yang mempunyai ikatan rangkap tiga adalah.....
A. CO2
B. SO2
C. SO3
D. PCl3
E. C2H2
JAWABAN BENAR
E.
C2H2
PEMBAHASAN
C2H2 memiliki ikatan kovalen rangkap 3:
HC=CH
6.
Kerjakan soal berikut ini dengan tepat!
Senyawa X mempunyai sifat sebagai berikut.
- Dalam keadaan padar tidak dapat menghantarkan listrik
- Larutannya dapat menghantarkan listrik
- Berwujud keras tetapi rapuh
Jenis ikatan dalam senyawa X tersebut adalah …
A. ion
B. logam
C. kovalen polar
D. kovalen non polar
E. kovalen koordinasi
JAWABAN BENAR
A.
ion
PEMBAHASAN
Sifat-sifat Senyawa Ion antara lain:
- Kristalnya keras tetapi rapuh.
- Mempunyai titik lebur dan titik didih yang tinggi.
- Mudah larut dalam air.
- Dapat menghantarkan arus listrik.
7.
Kerjakan soal berikut ini dengan tepat!
Struktur lewis senyawa ammonium klorida adalah sebagai berikut.
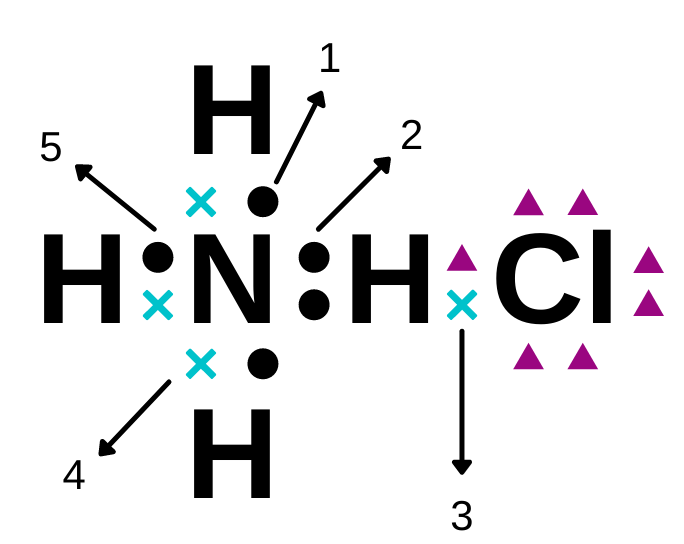
Ikatan kovalen koordinasi ditunjukkan oleh nomor ….
A. 1
B. 2
C. 3
D. 4
E. 5
JAWABAN BENAR
B.
2
PEMBAHASAN
Ikatan kovalen koordinasi adalah ikatan kovalen yang pemakaian elektron bersamanya hanya berasal dari satu atom.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

