Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Kesetimbangan Kimia
MATERI
Pergeseran Kesetimbangan

Azas Le Chatelier menjelaskan bagaimana terjadinya pergeseran kesetimbangan. "Bila suatu kesetimbangan diberikan suatu aksi/tindakan, maka sistem tersebut akan mengadakan reaksi yang cenderung mengurangi aksi tersebut".
Pergeseran kesetimbangan tidak mengubah nilai Kc dan Kp, kecuali suhu pada sistem kesetimbangan berubah.
Konsep pergeseran kesetimbangan:
- Kesetimbangan dikatakan bergeser ke kiri apabila zat di kiri bertambah atau zat di kanan berkurang.
- Kesetimbangan dikatakan bergeser ke kanan apabila zat di kanan bertambah atau zat di kiri berkurang.
Berikut merupakan faktor-faktor yang mempengaruhi pergeseran kesetimbangan:
Pengaruh Konsentrasi
- Jika konsentrasi diperbesar pada reaktan atau produk, kesetimbangan akan bergerak ke arah sisi (reaktan atau produk) yang konsentrasinya tidak diperbesar.
- Jika konsentrasi diperkecil pada reaktan atau produk, kesetimbangan akan bergerak ke arah sisi (reaktan atau produk) yang konsentrasinya diperkecil.
Pengaruh Tekanan
- Jika tekanan diperbesar (volume diperkecil), kesetimbangan akan bergerak ke arah yang jumlah koefisiennya terkecil.
- Jika tekanan diperkecil (volume diperbesar), kesetimbangan akan bergerak ke arah yang jumlah koefisiennya terbesar.
Pengaruh Suhu
- Jika suhu dinaikkan, kesetimbangan akan bergeser ke arah reaksi endoterm.
- Jika suhu diturunkan, kesetimbangan akan bergeser ke arah reaksi eksoterm.
Pengaruh Katalis
Katalis dapat mempercepat pencapaian keadaan setimbang, namun katalis tidak mengubah komposisi kesetimbangan.
Kesetimbangan dalam Industri

Dalam industri, reaksi kesetimbangan dibuat sedemikian rupa sehingga menggeser kesetimbangan ke arah produk, dengan cara sesederhana mungkin dan seefisien mungkin.
Pembuatan Amonia menurut Proses Haber-Bosch
Dengan reaksi:
N2(g) + 3H2(g) <==> 2NH3(g)
Proses ini melalui beberapa tahap sebagai berikut:
- Katalis yang digunakan adalah serbuk Fe.
- Suhu dibuat tinggi. Sebenarnya, kesetimbangan akan bergeser ke kanan bila suhu dibuat rendah. Akan tetapi, katalis hanya bekerja pada suhu tinggi, sehingga tidak dibuat rendah.
- Tekanan dibuat tinggi. Agar kesetimbangan bergeser ke kanan (NH3 bertambah), tekanan dibuat tinggi. Selain itu, untuk mengurangi reaksi balik, amonia yang terbentuk segera dipisahkan.
Pembuatan Asam Sulfat menurut Proses Kontak
Proses ini melalui beberapa tahap sebagai berikut.
- Belerang dibakar dengan oksigen menghasilkan belerang dioksida.
Reaksi yang terjadi:
S(s) + O2(g) ---> SO2(g) - Belerang dioksida (SO2) direaksikan dengan oksigen membentuk gas belerang trioksida.
Reaksi yang terjadi:
2SO2(g) + O2(g) <==> 2SO3(g) - Reaksi di atas berlangsung sangat lambat, sehingga harus diberi katalis. Katalis yang digunakan adalah vanadium pentoksida (V2O5). Selain itu, reaksi harus terjadi pada suhu optimum (450oC).
- Gas SO3 direaksikan dengan asam sulfat pekat menghasilkan asam disulfat atau asam pirosulfat (oleum).
H2SO4(l) + SO3(g) ---> H2S2O7(l) - Asam pirosulfat (H2S2O7) dilarutkan dalam air menghasilkan H2SO4.
Persamaan reaksi yang terjadi:
H2S2O7(l) + H2O(l) ---> 2H2SO4(l)
Agar lebih mudah memahami pembuatan asam sulfat dengan proses tersebut, perhatikan skema proses kontak berikut:
Pembuatan Gas Klor (Cl2)
Pembuatan gas klor dilakukan dengan proses Deacon. Caranya dengan mengoksidasi gas asam klorida dengan oksigen di udara. Reaksinya berlangsung dengan persamaan sebagai berikut.
2HCI(g) + 1/2O2(g) <==> H2O(g) + Cl2(g)
Reaksi tersebut dapat dipercepat dengan katalis CuCI2. Selain dengan katalis, reaksi dapat dipercepat dengan mengatur suhu optimal reaksi, yaitu sekitar 430°C dan tekanan 200 atm. Hal ini karena reaksi kesetimbangan tersebut berlangsung secara eksoterm.
1.
Jawablah soal berikut ini!
Di bawah ini merupakan faktor-faktor yang mempengaruhi pergeseran kesetimbangan, kecuali
A. Pengaruh Konsentrasi
B. Pengaruh Tekanan
C. Pengaruh Volume
D. Pengaruh Suhu
E. Pengaruh Katalis
JAWABAN BENAR
E.
Pengaruh Katalis
PEMBAHASAN
Faktor-faktor yang mempengaruhi pergeseran kesetimbangan adalah Pengaruh Konsentrasi, Pengaruh Tekanan, Pengaruh Suhu, dan Pengaruh Volume. Penambahan Katalis hanya mempercepat tercapainya kesetimbangan, tidak mempengaruhi pergeseran reaksi.
2.
Jawablah soal berikut ini!
Pernyataan di bawah ini yang benar tentang Pengaruh Konsentrasi adalah....
A. Jika konsentrasi pereaksi diperbesar, kesetimbangan akan bergerak ke kanan. Jika konsentrasi pereaksi diperkecil, kesetimbangan akan bergerak ke kiri
B. Jika konsentrasi pereaksi diperbesar, kesetimbangan akan bergerak ke kanan. Jika konsentrasi pereaksi diperkecil, kesetimbangan akan bergerak ke kanan
C. Jika konsentrasi pereaksi diperbesar, kesetimbangan akan bergerak ke kiri. Jika konsentrasi pereaksi diperkecil, kesetimbangan akan bergerak ke kiri
D. Jika konsentrasi pereaksi diperbesar, kesetimbangan akan bergerak ke kiri. Jika konsentrasi pereaksi diperkecil, kesetimbangan akan bergerak ke kanan
E. Jika konsentrasi pereaksi diperbesar, kesetimbangan akan bergerak ke kanan. Jika konsentrasi pereaksi diperkecil, kesetimbangan tidak akan bergerak
JAWABAN BENAR
A.
Jika konsentrasi pereaksi diperbesar, kesetimbangan akan bergerak ke kanan. Jika konsentrasi pereaksi diperkecil, kesetimbangan akan bergerak ke kiri
PEMBAHASAN
Jika konsentrasi pereaksi diperbesar, kesetimbangan akan bergerak ke kanan.
Jika konsentrasi pereaksi diperkecil, kesetimbangan akan bergerak ke kiri.
3.
Jawablah soal berikut ini!
Perhatikan reaksi berikut!
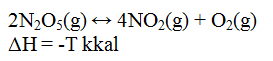
Reaksi kesetimbangan bergeser kekiri jika....
A. konsentrasi O2 ditambah
B. suhu diturunkan
C. tekanan diperkecil
D. konsentrasi NO2 dikurangi
E. volume diperbesar
JAWABAN BENAR
B.
suhu diturunkan
PEMBAHASAN
Jika suhu diturunkan reaksi kesetimbangan bergeser ke kiri. Jika suhu dinaikkan reaksi kesetimbangan bergeser kekanan.
4.
Jawablah soal berikut ini!
Salah satu cara untuk memperoleh amonia adalah dengan menggunakan proses....
A. Bilik timbal
B. Tanur tinggi
C. Haber-Bosch
D. Hall-Heroult
E. Proses kontak
JAWABAN BENAR
C.
Haber-Bosch
PEMBAHASAN
Salah satu cara memperoleh amonia adalah dengan menggunakan proses Haber-Bosch.
5.
Jawablah soal berikut ini!
Katalis yang digunakan dalam proses kontak pembuatan asam sulfat adalah....
A. Pt
B. Cu
C. Fe2O3
D. V2O5
E. Ti
JAWABAN BENAR
D.
V2O5
PEMBAHASAN
Proses kontak untuk memperoleh asam sulfat menggunakan katalis V2O5.
6.
Jawablah soal berikut ini!
Agar pada reaksi kesetimbangan:
![]()
Jumlah gas NO yang dihasilkan maksimal, maka tindakan yang diperlukan adalah….
A. Menaikan tekanan
B. Menurunkan tekanan
C. Mengecilkan volume
D. Menaikan suhu
E. Memperbesar volume
JAWABAN BENAR
B.
Menurunkan tekanan
PEMBAHASAN
Menurut Azas Le Chatelier, jika sistem dalam kesetimbangan terjadi kenaikan suhu, maka akan terjadi pergeseran kesetimbangan ke arah reaksi yang menyerap kalor (Apabila koefisien sama antara produk dan reaksi maka volume dan tekanan tidak mempengaruhi reaksi.
Reaksi diatas termasuk reaksi endoterm jadi jika dinaikkan suhu maka kesetimbangan akan bergeser ke arah reaksi endoterm atau bergeser ke arah kanan (NO), jika reaksi bergeser ke arah kanan maka nilai Kc akan semakin besar.
7.
Jawablah soal berikut ini!
Pembuatan gas NH3 di pabrik:
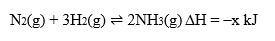
Hasil gas NH3 dapat diperbesar dengan cara….
A. Memperbesar tekanan
B. Memperbesar volume
C. Memperbesar temperatur
D. Menambah katalis
E. Mengurangi gas N2
JAWABAN BENAR
A.
Memperbesar tekanan
PEMBAHASAN
Pembesaran tekanan menyebabkan kesetimbangan bergeser ke arah yang jumlah koefisien reaksinya lebih kecil . Akibatnya, hasil gas NH3 dapat diperbesar.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

