Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Struktur Atom dan Sistem Periodik Unsur
MATERI
Teori Atom John Dalton

Struktur atom adalah susunan partikel dasar dalam atom. Atom sebagai partikel penyusun materi dapat menentukan sifat materi. Atom berasal dari Bahasa Yunani yaitu atomos yang berarti partikel terkecil yang tidak dapat dibagi lagi. Atom memang tidak dapat dilihat dengan kasat mata, namun kita dapat melihat visualisasi atom dalam perkembangan model atom berdasarkan hasil eksperimen dari para ilmuwan. Kebenaran suatu model atau teori atom tidak mutlak. Dalam perkembangannya model atau teori atom terus mengalami perbaikan dan penyempurnaan.
Teori atom John Dalton

Dalton mengemukakan tentang atom sebagai berikut:
- Atom adalah bola pejal yang tidak bermuatan.
- Atom bagian terkecil suatu materi yang tidak dapat dibagi lagi.
- Atom dari suatu unsur yang sama memiliki berat, ukuran, dan bentuk yang sama, tetapi berbeda dengan atom-atom unsur lain.
- Atom tidak dapat diciptakan dan dimusnahkan.
- Pada reaksi kimia terjadi penggabungan dan pemisahan atom.
- Senyawa adalah hasil reaksi atom-atom penyusunnya.
Adapun kelebihan dan kelemahan dari teori atom Dalton, yaitu sebagai berikut:
Kelebihan:
- Meningkatkan rasa minat terhadap penelitian model atom berikutnya.
- Mampu menjelaskan Hukum Kekelalan Massa, Hukum Perbandingan Tetap, dan Hukum Perbandingan Berganda.
Kelemahan:
- Tidak dapat menjelaskan tentang bagaimana cara atom-atom saling berikatan.
- Tidak dapat menjelaskan hubungan antara larutan senyawa dengan daya hantar arus listrik, karena atom merupakan bagian terkecil dari suatu unsur yang tidak bisa dibagi lagi.
- Tidak dapat menjelaskan sifat listrik materi.
- Tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan atom unsur yang lain.
- Belum melibatkan partikel subatomik antaralain proton, elektron, dan neutron.
Poin kunci pada model atom Dalton yaitu, atom merupakan partikel terkecil berbentuk bulat yang tidak bermuatan dan dapat melakukan penggabungan kimia.
Teori Atom J.J. Thomson

Teori atom J.J. Thomson
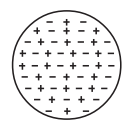
Thomson mengemukakan tentang atom sebagai berikut:
- Atom merupakan bola pejal yang bermuatan positif.
- Tersebar elektron yang bermuatan negatif secara rata di dalam atom.
- Jumlah muatan positif sama dengan jumlah muatan negatif, sehingga atom bersifat netral.
Adapun kelebihan dan kelemahan dari teori atom Thomson, yaitu sebagai berikut:
Kelebihan
- Membuktikan bahwa atom bukan merupakan bagian terkecil dari suatu unsur. Hal itu karena Thomson menemukan adanya partikel lain yang bermuatan negatif dalam atom.
- Membuktikan bahwa atom bersifat netral yang tersusun dari partikel-partikel yang bermuatan positif dan negatif.
- Membuktikan bahwa adanya elektron dalam semua unsur.
- Membuktikan bahwa adanya elektron dalam semua unsur.
- Melibatkan partikel subatomik berupa elektron.
Kekurangan
- Tidak dapat menjelaskan tentang susunan muatan positif.
- Tidak dapat menjelaskan tentang inti atom.
Poin kunci pada model atom Thomson yaitu, atom merupakan suatu bola pejal bermuatan positif dan memiliki electron bermuatan negatif yang tersebar secara merata di dalam atom. Sehingga, teori atom Thomson sering disebut dengan teori roti kismis, mengibaratkan roti adalah atom yang bermuatan positif dan kismis adalah elektron yang menyebar secara merata pada atom.
Teori Atom Rutherford

Teori atom Rutherford
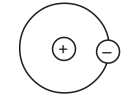
Rutherford mengemukakan tentang atom sebagai berikut:
- Elektron yang bermuatan negatif bergerak mengelilingi inti atom yang bermuatan positif dengan kecepatan yang sangat tinggi.
- Atom mempunyai inti atom (bermuatan positif) yang menjadi pusat massa atom.
- Penyebaran partikel alfa tidak dipengaruhi oleh awan elektron.
- Sebagian besar dari atom merupakan permukaan yang hampa atau kosong.
- Sebagian kecil partikel alfa yang lewat akan dibelokkan dan sedikit sekali dipantulkan. Sebagian besar lainnya tidak mengalami pembelokkan/hambatan.
Adapun kelebihan dan kelemahan dari teori atom Rutherford, yaitu sebagai berikut:
Kelebihan
- Dapat menggambarkan dan menjelaskan bentuk lintasan elektron yang mengelilingi inti atom, sehingga mudah dipahami.
- Dapat menyimpulkan bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti atom yang dimana satu sama lain terpisah oleh ruang hampa.
- Dapat menjelaskan pergerakan elektron disekitar inti atom
Kekurangan
- Tidak mampu menjelaskan mengapa elektron tidak pernah jatuh ke dalam inti atom sesuai dengan teori fisika klasik.
- Tidak mampu menjelaskan tentang spektrum garis pada atom hidrogen (H).
- Tidak mampu menjelaskan letak elektron dan cara rotasinya terhadap inti atom.
- Elektron yang bergerak akan memancarkan energi, sehingga energi atom menjadi tidak stabil.
Poin kunci pada model atom Rutherford yaitu, atom terdiri atas inti atom yang berukuran sangat kecil dan bermuatan positif, dikelilingi elektron yang bergerak pada lintasannya.
Teoti Atom Niels Bohr

Teori atom Niels Bohr
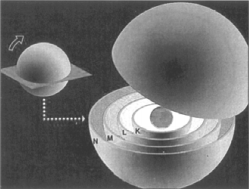
Bohr mengemukakan tentang atom sebagai berikut:
- Elektron dalam atom bergerak melalui lintasan yang merupakan tingkat energi tertentu, dengan demikian elektron juga mempunyai energi tertentu.
- Selama bergerak dalam lintasannya elektron tidak memancarkan energi disebut keadaan stationer atau dasar.
- Elektron dalam atom dapat menyerap energi dan pindah ke lintasan/tingkat energi yang lebih tinggi (disebut eksitasi atau promosi).
Adapun kelebihan dan kelemahan dari teori atom Bohr, yaitu sebagai berikut:
Kelebihan
- Dapat memperbaiki kelemahan dari teori atom Rutherford.
- Dapat membuktikan adanya lintasan elektron untuk atom hidrogen.
- Dapat menjelaskan spektrum atom hidrogen secara akurat.
Kekurangan
- Tidak dapat menjelaskan spektrum warna dari atom-atom yang mempunyai banyak elektron atau yang lebih kompleks.
- Tidak dapat menjelaskan adanya garis-garis halus dalam spektrum hidrogen (efek Zeeman) karena Bohr menganggap elektron sebagai partikel.
- Model atom Bohr memiliki nilai momentum sudut lintasan ground state yang salah.
- Tidak bisa mengetahui intensitas relatif garis spektra.
- Tidak bisa menjelaskan struktur garis spektra yang baik.
- Tidak dapat menjelaskan atom selain atom hidrogen.
Poin kunci pada model atom Bohr yaitu, atom terdiri dari inti atom yang mengantung proton dan neutron, sedangkan elektron bergerak mengelilingi inti atom pada lintasan-lintasan tertentu yang disebut kulit electron atau tingkat energi elektron.
Teori Atom Mekanika Kuantum

Teori atom Mekanika Kuantum
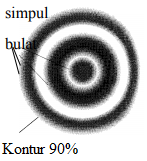
Teori Atom Mekanika Kuantum didasarkan pada dualisme sifat elektron, yaitu sebagai gelombang dan sebagai partikel.
Menurut de Broglie, cahaya dapat berperilaku sebagai materi dan berperilaku sebagai gelombang (dikenal dengan istilah dualisme gelombang partikel). Menurut Heisenberg, tidak mungkin menentukan kecepatan dan posisi elektron secara bersamaan, tetapi yang dapat ditentukan hanyalah kebolehjadian menemukan elektron pada jarak tertentu dari inti.
Erwin Schrodinger mengajukan teori yang disebut teori atom mekanika kuantum ”Kedudukan elektron dalam atom tidak dapat ditentukan dengan pasti yang dapat ditentukan adalah kemungkinan menemukan elektron sebagai fungsi jarak dari inti atom”.
Daerah dengan kemungkinan terbesar ditemukan elektron disebut orbital. Orbital digambarkan berupa awan, yang tebal tipisnya menyatakan besar kecilnya kemungkinan ditemukan elektron di daerah tersebut. Kemudian Werner Heisenberg mengemukakan bahwa metode eksperimen yang digunakan untuk menemukan posisi atau momentum suatu partikel seperti elektron dapat menyebabkan perubahan, baik pada posisi, momentum atau keduanya.
Teori Schrodinger dan prinsip ketidakpastian Heisenberg melahirkan model atom mekanika kuantum sebagai berikut:
- Posisi elektron dalam atom tidak dapat ditentukan dengan pasti.
- Atom mempunyai kulit elektron.
- Setiap kulit elektron memiliki subkulit elektron.
- Setiap subkulit elektron memiliki sub-sub kulit elektron.
1.
Kerjakan soal berikut ini dengan tepat!
Perhatikan gambar teori atom berikut!
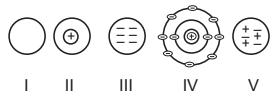
Yang menunjukkan teori atom Dalton adalah....
A. I
B. II
C. III
D. IV
E. V
JAWABAN BENAR
B.
II
PEMBAHASAN
Teori atom Dalton, atom diibaratkan seperti bola pejal, belum terdapat teori tentang muatan yang ada pada atom tersebut.
2.
Kerjakan soal berikut ini dengan tepat!
Analogi model atom seperti roti kismis merupakan teori model atom dari...
A. Thomson
B. Bohr
C. Mekanika gelombang
D. Dalton
E. Rutherford
JAWABAN BENAR
A.
Thomson
PEMBAHASAN
Model atom Thomson dianalogikan seperti roti kismis
3.
Kerjakan soal berikut ini dengan tepat!
Kelemahan teori atom Niels Bohr adalah ....
A. tidak dapat menjelaskan spektrum unsur hidrogen
B. bertentangan dengan hukum–hukum fisika klasik dari Maxwell
C. tidak dapat menentukan posisi elektron dengan pasti
D. bertentangan dengan teori atom Dalton bahwa atom–atom suatu unsur identik
E. tidak dapat menentukan perubahan energi pada perpindahan elektron dalam atom
JAWABAN BENAR
C.
tidak dapat menentukan posisi elektron dengan pasti
PEMBAHASAN
Kelemahan teori atom Niels Bohr adalah tidak dapat menentukan posisi elektron dengan pasti, karena posisi elektron ditentukan setelah adanya bilangan kuantum.
4.
Kerjakan soal berikut ini dengan tepat!
Kelemahan teori atom Rutherford adalah tidak adanya penjelasan tentang....
A. Partikel penyusun inti atom
B. Massa atom berpusat pada inti
C. Elektron mengitari inti pada jarak tertentu
D. Inti atom yang bermuatan positif
E. Elektron yang memiliki energi tetap
JAWABAN BENAR
E.
Elektron yang memiliki energi tetap
PEMBAHASAN
Rutherford dalam teorinya menjelaskan bahwa:
- Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif.
- Massa atom terpusat pada inti
- Sebagian besar volume atom adalah ruang hampa
- Atom bersifat netral (jumlah proton sama dengan elektron )
Kelemahan teori atom Rutherford adalah tidak menjelaskan bahwa elektron memiliki energi yang tetap.
5.
Kerjakan soal berikut ini dengan tepat!
Pernyataan berikut terkait teori atom dari John Dalton:
- Atom berbentuk bola pejal yang sangat kecil
- Atom merupakan partikel terkecil yang tidak dapat dibagi lagi
- Atom dari unsur yang sama memiliki sifat sama, sedangkan atom dari unsur yang berbeda memiliki massa dan sifat yang berbeda
- Reaksi kimia tidak dapat merubah suatu atom menjadi atom lain
Dari pernyataan di atas yang menjadi kelemahan teori atom Dalton adalah pernyataan….
A. 1, 2 dan 3
B. 2 dan 4
C. 1 dan 3
D. 4
E. 1, 2, 3 dan 4
JAWABAN BENAR
E.
1, 2, 3 dan 4
PEMBAHASAN
Teori atom Dalton menjelaskan bahwa :
- Materi tersusun atas partikel kecil disebut atom
- Atom tidak dapat dipecah menjadi partikel yang lebih kecil lagi
- Atom unsur tertentu mempunyai sifat dan massa yang identik.
- Atom bergabung membentuk senyawa dengan perbandingan bulat dan sederhana.
- Reaksi kimia adalah reaksi pemisahan, penataan ulang dan penggabungan kembali atom atom.
6.
Kerjakan soal berikut ini dengan tepat!
Di bawah ini adalah pernyataan yang benar mengenai Teori Atom Rutherford, kecuali ….
A. Atom mempunyai inti yang bermuatan positif.
B. Elektron bergerak pada lintasan yang menunjukan tingkatan energi.
C. Sebagian kecil partikel alfa dibelokkan dan dipantulkan.
D. Elektron bergerak mengelilingi inti atom.
E. Sebagian besar partikel alfa menembus lempeng emas.
JAWABAN BENAR
B.
Elektron bergerak pada lintasan yang menunjukan tingkatan energi.
PEMBAHASAN
Teori atom Rutherford didapatkan melalui uji sinar alfa menggunakan lempeng emas. Sinar alfa yang bermuatan positif ditembakkan pada lempeng emas yang sangat tipis. Percobaan menunjukkan bahwa sebagian besar sinar alfa dapat menembus lempeng emas tersebut, sebagian kecil dibelokkan dan dipantulkan. Hal ini menunjukkan, bahwa sinar alfa yang bermuatan positif ditolak oleh sesuatu yang bermuatan positif juga dalam atom. Rutherford menyimpulkan muatan positif (proton) tersebut terpusat pada inti atom yang dikelilingi oleh elektron. Penjelasan mengenai elektron yang bergerak pada lintasan tertentu yang menunjukkan tingkatan energi, terdapat pada Teori atom Bohr.
7.
Kerjakan soal berikut ini dengan tepat!
Teori Schrodinger dan prinsip ketidakpastian Heisenberg melahirkan model atom mekanika kuantum dimana setiap kulit elektron memiliki …
A. subkulit elektron
B. kulit
C. lintasan
D. sub-subkulit elektron
E. orbital
JAWABAN BENAR
A.
subkulit elektron
PEMBAHASAN
Teori Schrodinger dan prinsip ketidakpastian Heisenberg melahirkan model atom mekanika kuantum sebagai berikut:
- Posisi elektron dalam atom tidak dapat ditentukan dengan pasti.
- Atom mempunyai kulit elektron.
- Setiap kulit elektron memiliki subkulit elektron.
- Setiap subkulit elektron memiliki sub-sub kulit elektron.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

