Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Hukum Dasar Kimia, Konsep Mol, dan Stoikiometri
MATERI
Penentuan Mol, Massa, dan Volume Zat dalam Reaksi

Prinsip stoikiometri reaksi umum untuk menemukan mol, massa dan volume zat yang direaksikan dan dihasilkan:
- Perbandingan koefisien adalah perbandingan jumlah mol zat dalam reaksi.
- Segala satuan ukuran zat harus dikonversikan ke dalam mol.
Contoh:
KO2 direaksikan dengan 132 gram CO2, menurut reaksi:
4KO2(s) + 2CO2(g) --> 2K2CO3(s) + 3O2(g)
(Ar K = 39, O = 16, C = 12)
Tentukan:
- Jumlah mol gas karbondioksida
- Massa kalium superoksida yang direaksikan
- Massa kalium karbonat yang dihasilkan
- Jumlah liter gas yang dihasilkan jika reaksi terjadi pada suhu 27oC dan tekanan 3 atm
Jawab:
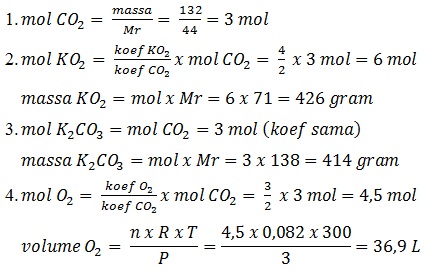
Suatu sampel atau cuplikan unsur dapat diketahui mol dan massa zat murninya bila direaksikan.
Contoh:
Suatu 36 gram cuplikan logam magnesium dengan kemurnian 90% dimasukkan ke dalam larutan asam nitrat 2 M menurut reaksi:
3Mg(s) + 8HNO3(aq) --> 3Mg(NO3)2(aq) + 4H2O(l) + 2NO(g)
(Ar Mg = 24, H = 1, N = 14, O = 16)
Tentukan:
- Mol Mg murni
- Massa Mg murni
- Volume larutan HNO3 yang dibutuhkan
- Volume NO yang dihasilkan pada (p,t) dimana massa 1,2 L gas N2 adalah 1,4 gr
Jawab:
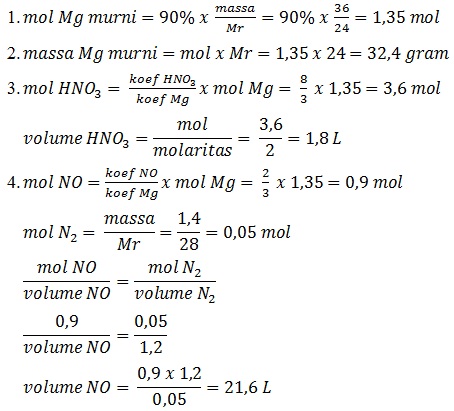
Pereaksi Pembatas

Suatu pereaksi berlebih dalam reaksi akan bersisa karena jumlah zatnya tidak sesuai dengan perbandingan koefisien.
Pereaksi pembatas adalah pereaksi yang habis lebih dahulu bereaksi. Cara menentukan pereaksi pembatas adalah dengan membagi masing-masing mol zat pereaksi dengan koefisiennya. Nilai yang lebih kecil merupakan pereaksi pembatas.
Contoh:
Pada reaksi berikut, 97,5 gr zink direaksikan dengan 500 mL HCl 4 M.
Zn(s) + 2HCl(aq) --> ZnCl2(aq) + H2(g)
Tentukan pereaksi pembatas dan massa sisa zat!
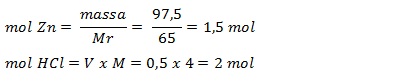
Jumlah zat tidak sama dengan perbandingan koefisien,
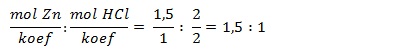
Maka HCl merupakan pereaksi pembatas.
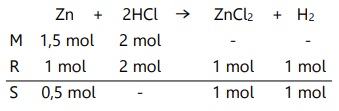
Massa Zn sisa = 0,5 x 65 = 32,5 gram
Rumus Molekul dan Rumus Empiris

Rumus molekul adalah rumus senyawa yang nyata sesuai dengan jumlah atom-atom unsur penyusun senyawa.
Rumus empiris adalah rumus perbandingan paling sederhana dari atom-atom unsur penyusun senyawa.
Contoh:
Rumus molekul C6H12O6 mempunyai rumus empiris CH2O.
Contoh soal:
Tentukan rumus empiris dan rumus molekul senyawa yang mengandung 29,11% D, 40,51% E, dan 30,38% F dan memiliki Mr = 316.
(Ar D = 23, E = 32, F = 16)
Jawab:
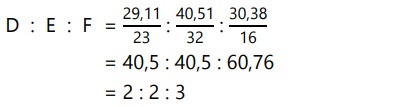
Maka, rumus empiris adalah D2E2F3.
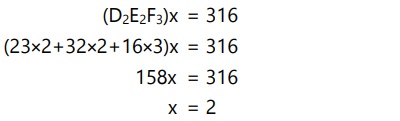
Maka, rumus molekul adalah (D2E2F3)2 atau D4E4F6.
Kadar Unsur dan Rumus Senyawa Hidrat

Massa unsur dalam suatu senyawa dapat dihitung:
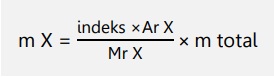
Kadar unsur dalam suatu senyawa dapat dihitung:

Senyawa hidrat adalah senyawa berbentuk padat yang mengikat beberapa molekul air sebagai bagian dari struktur kristalnya.
Contoh:
Garam inggris dengan rumus hidrat MgSO4 . 7H2O.
Contoh soal:
Tentukan rumus kimia hidrat 1 gram senyawa CuSO4 . xH2O yang bila dipanaskan menghasilkan 0,64 gram padatan!
Jawab:
Reaksi yang terjadi adalah:

Maka rumus kimia hidrat adalah CuSO4 . 5H2O
1.
Senyawa hidrokarbon (Mr = 56) mengandung 24 g unsur karbon dan 4 g unsur hidrogen. Tentukan rumus molekul senyawa jika Ar: C = 12 dan H = 1.
A. C2H4
B. C3H6
C. C4H8
D. C5H10
E. C6H12
JAWABAN BENAR
C.
C4H8
PEMBAHASAN
2.
Suatu senyawa hidrokarbon memiliki komposisi zat 80% unsur karbon dan 20% unsur hidrogen. Tentukan rumus empirisnya jika Ar C = 12 dan Ar H = 1.
A. CH4
B. CH3
C. C2H4
D. C2H2
E. C3H8
JAWABAN BENAR
B.
CH3
PEMBAHASAN
Rumus empiris ditentukan dari persentase komposisi yang dianggap berat senyawa tersebut 100 g.
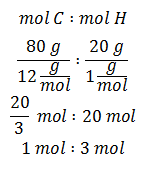
Rumus empiris senyawa hidrokarbon tersebut adalah CH3.
3.
Sewaktu sampel hidrat dari tembaga (II) sulfat dipanaskan, massanya berkurang sebanyak 36%. Rumus molekul hidrat tersebut adalah..... (Ar Cu = 63,5; S = 32; O = 16; H = 1)
A. CuSO4 . 5H2O
B. CuSO4 . 4H2O
C. CuSO4 . 3H2O
D. CuSO4 . 2H2O
E. CuSO4 . H2O
JAWABAN BENAR
A.
CuSO4 . 5H2O
PEMBAHASAN
Misalkan massa kristal = 100 gram
Massa kristal berkurang 36 %, sehingga massa kristal yang tersisa adalah:
Massa CuSO4 = (100 - 36) gram = 64 gram
Massa H2O = 36 gram
Perbandingan mol CuSO4 . H2O =
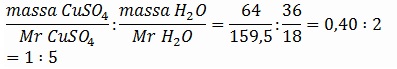
4.
Aluminium larut dalam asam sulfat menghasilkan aluminium sulfat dan gas hidrogen
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
Berapa mol gas hidrogen dapat dihasilkan jika digunakan 0,5 mol aluminium....
A. 0,65 mol
B. 0,75 mol
C. 0,95 mol
D. 0,085 mol
E. 0,095 mol
JAWABAN BENAR
B.
0,75 mol
PEMBAHASAN
Ditentukan jumlah mol salah satu zat dalam reaksi, kemudian diminta menentukan jumlah mol lainnya. Hal ini dapat dilakukan berdasarkan perbandingan koefisien reaksinya.
Jumlah mol zat ditanya:
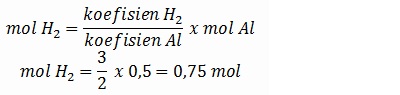
5.
Jawablah soal berikut ini!
Logam magnesium dengan massa 3 gram direaksikan dengan larutan asam klorida yang mengandung HCl 40 gram. Reaksi yang terjadi adalah:
Mg + HCl --> MgCl2 + H2
Tentukan volume hidrogen yang dihasilkan pada keadaan standar!
A. 2,8 liter
B. 3,0 liter
C. 3,6 liter
D. 4,0 liter
E. 5,6 liter
JAWABAN BENAR
A.
2,8 liter
PEMBAHASAN
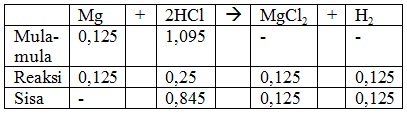
Mol = massa/Mr
Mol Mg = 3/24 = 0,125 mol
Mol HCl = 40/36,5 = 1,095 mol
Reaksi setara =
Mg + 2HCl --> MgCl2 + H2
Volume H2 = mol x 22,4
Volume H2 = 0,125 x 22,4 = 2,8 liter

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


