Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Kesetimbangan Kimia
MATERI
Reaksi Kesetimbangan

Reaksi Kimia (Reversible dan Irreversible)
Berdasarkan arahnya, reaksi dapat dibedakan menjadi reaksi berkesudahan (irreversible/satu arah) dan reaksi bolak balik (reversibel/dua arah).
Pada reaksi berkesudahan, hasil reaksi tidak dapat diubah lagi menjadi zat pereaksi. Misalnya, pada reaksi pembakaran kayu atau proses pengkaratan besi. Abu atau arang hasil pembakaran tidak dapat diubah kembali menjadi kayu seperti semula.
Di lain pihak, ada reaksi bolak balik, yaitu reaksi yang berlangsung dalam dua arah dimana zat-zat hasil reaksi dapat bereaksi kembali membentuk zat pereaksi. Sebagai contoh, reaksi antara timbal (II) sulfat dengan natrium iodida.
- Jika serbuk timbal (II) sulfat direaksikan dengan larutan natrium iodida, terbentuk endapan kuning dari timbal (II) iodida:
PbSO4(s) + 2NaI(aq) ---> PbI2(s) + Na2SO4(aq) - Sebaliknya, bila endapan timbal (II) iodida direaksikan dengan larutan natrium sulfat, maka akan terbentuk kembali endapan timbal (II) sulfat yang berwarna putih:
PbI2(s) + Na2SO4(aq) ---> PbSO4(s) + 2NaI(aq) - Kedua reaksi tersebut dapat digabungkan sebagai berikut :
PbSO4(s) + 2NaI(aq) <==> PbI2(s) + Na2SO4(aq)
Penulisan reaksi bolak balik ditandai dengan dua panah yang arahnya berlawanan.
Dengan demikian, pada reaksi tersebut terjadi proses kesetimbangan dinamis, yaitu proses bolak balik yang lajunya sama untuk kedua arah.
Kesetimbangan Kimia
Ciri-ciri Kesetimbangan Kimia:
- Reaksi berlangsung dua arah dan dalam ruang tertutup.
- Laju reaksi ke kiri = laju reaksi ke kanan.
- Tidak terjadi perubahan makroskopis, tetapi terjadi perubahan mikroskopis.
Perhatikan grafik kesetimbangan berikut ini:
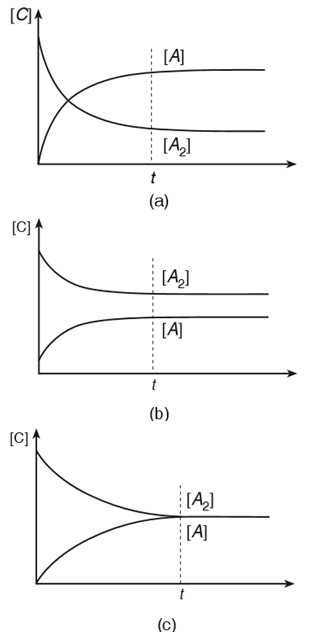
- Grafik (a), Pada saat setimbang konsentrasi produk ([A]) lebih besar daripada konsentrasi reaktan ([A2]).
- Grafik (b), Pada saat setimbang konsentrasi produk ([A]) lebih kecil daripada konsentrasi reaktan ([A2]).
- Grafik (c), Pada saat setimbang konsentrasi produk ([A]) sama dengan konsentrasi reaktan ([A2]).
Reaksi Kesetimbangan Homogen dan Heterogen
- Reaksi Kesetimbangan Homogen
Reaksi kesetimbangan homogen merupakan reaksi kesetimbangan dengan komponen berfase sama dapat berupa sistem gas atau larutan.
Contoh kesetimbangan reaksi homogen dengan komponen reaksinya gas:
N2(g) + 3H2(g) <==> 2NH3(g)
Semua komponen baik reaktan maupun produk reaksi adalah berfase gas - Reaksi Kesetimbangan Heterogen
Reaksi kesetimbangan heterogen merupakan reaksi dengan komponen reaksinya terdiri dari fase yang berbeda dapat dua atau lebih fase yang berbeda
Contoh kesetimbangan reaksi heterogen adalah sebagai berikut:
CaCO3(s) <==> CaO(s) + CO2(g)
Reaksi tersebut terdiri dari dua fase, yaitu padatan dan gas. Reaktan terdiri dari senyawa yang berfase padat, sedangkan produk terdiri dari senyawa padat, yaitu CaO dan fase gas, yaitu CO2
Konstanta Kesetimbangan

Menurut Guldberg dan Wange yang menjelaskan hukum kesetimbangan "Hasil kali konsentrasi zat-zat di sebelah kanan yang dipangkatkan dengan koefisiennya, dan dibagi dengan hasil kali konsentrasi zat-zat di sebelah kiri yang dipangkatkan dengan koefisiennya memiliki harga tertentu pada suhu tetap".
Harga perbandingan yang tetap itu disebut tetapan kesetimbangan (konstanta kesetimbangan dengan lambang Kc, dengan huruf c menyatakan konsentrasi. Akan tetapi huruf c dapat dihilangkan, sehingga tetapan kesetimbangan hanya ditulis K saja.
Secara umum, suatu reaksi kesetimbangan dapat ditulis sebagai berikut:
wA + xB <==> yC +zD
Tetapan atau konstanta kesetimbangannya dirumuskan:
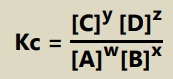
Beberapa hal penting mengenai konstanta kesetimbangan (Kc):
- Bila harga Kc > 1, berarti hasil reaksi pada kesetimbangan lebih banyak daripada pereaksi.
- Bila harga Kc < 1, berarti hasil reaksi pada kesetimbangan lebih sedikit daripada pereaksi.
Konstanta kesetimbangan terdiri dari:
- Konstanta konsentrasi, konstanta kesetimbangan yang dipengaruhi konsentrasi.
- Konstanta tekanan, konstanta kesetimbangan yang dipengaruhi tekanan.
Konstanta kesetimbangan akan berubah bila suhu diubah, dan tetap bila suhu tidak berubah.
- Pada reaksi endoterm, nilai konstantanya berbanding lurus dengan suhu.
- Pada reaksi eksoterm, nilai konstantanya berbanding terbalik dengan suhu.
Konstanta konsentrasi (Kc) dipengaruhi oleh konsentrasi zat yang berwujud larutan dan gas. Jika reaksi mengandung zat berwujud padat dan cair, maka pangkat konsentrasi zatnya nol, karena zat padat dan cair tidak memiliki konsentrasi.
Contoh:
Pada reaksi berikut, konstanta konsentrasinya:
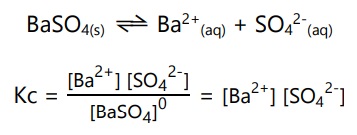
Konstanta tekanan (Kp) dipengaruhi oleh tekanan zat-zat yang berwujud gas. Jika reaksi mengandung zat berwujud selain gas, maka pangkat tekanan zatnya nol, karena zat selain gas tidak memiliki tekanan.
Contoh:
Pada reaksi berikut, konstanta tekanannya:
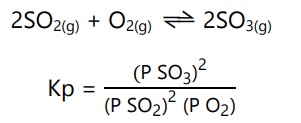
Jumlah tekanan parsial (P) tiap-tiap gas merupakan tekanan total (Ptotal) suatu campuran gas. Jika suatu reaksi kimia berikut:
xA2(aq) + yB2(aq) <==> zA2B2(aq)
Maka nilai dari Ptotal pada reaksi tersebut dalam satuan atm adalah:
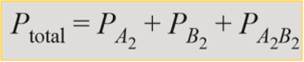
Dengan rumus tekanan parsialnya sebagai berikut:

Sehingga tekanan parsial pada reaksi diatas adalah:
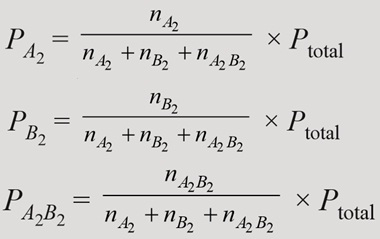
Satuan konstanta dapat disesuaikan dengan pangkat konsentrasi maupun pangkat tekanan. Konstanta konsentrasi dengan konstanta tekanan dapat dihubungkan melalui persamaan gas ideal pada suhu sama, dapat dirumuskan:

Nilai Konstanta Kesetimbangan pada Reaksi Kesetimbangan

Reaksi kesetimbangan yang berkaitan nilai konstanta kesetimbangannya dapat berubah menurut ketentuan-ketentuan berikut:
- Jika reaksi kesetimbangan dibalik, maka harga Kc juga dibalik.
Contoh:
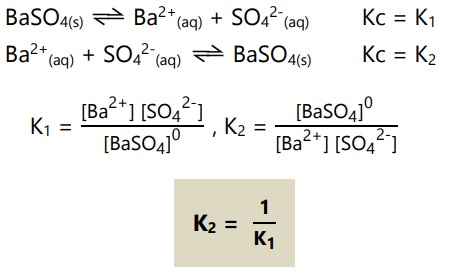
- Jika koefisien reaksi kesetimbangan dikali faktor n, maka harga Kc dipangkat n.
Contoh:
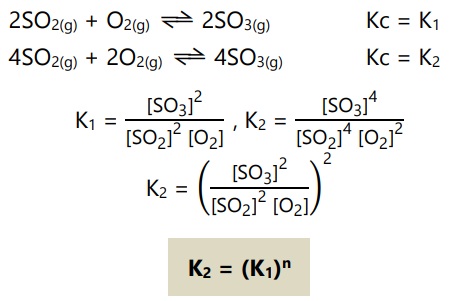
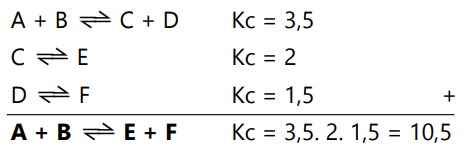
- Jika reaksi-reaksi yang berkaitan dijumlah, maka harga Kc total adalah hasil kali Kc dari reaksi-reaksi yang dijumlah.
Contoh: Nilai Kc reaksi A + B <==> E + F yang melalui tahap berikut adalah,
1.
Jawablah soal berikut ini!
Reaksi yang tidak dapat kembali menuju permulaannya disebut...
A. Reaksi Reversible
B. Reaksi Irreversible
C. Ketuntasan reaksi
D. Reaksi balik
E. Reaksi maju
JAWABAN BENAR
B.
Reaksi Irreversible
PEMBAHASAN
Reaksi Irreversible adalah Reaksi yang tidak dapat kembali menuju permulaannya
2.
Jawablah soal berikut ini!
Reaksi yang berlangsung searah disebut...
A. Reaksi Reversible
B. Reaksi Irreversible
C. Ketuntasan reaksi
D. Reaksi balik
E. Reaksi maju
JAWABAN BENAR
B.
Reaksi Irreversible
PEMBAHASAN
Reaksi irreversible adalah reaksi yang berlangsung searah.
3.
Jawablah soal berikut ini!
Suatu sistem reaksi dalam keadaan setimbang bila....
A. reaksi berlangsung dua arah pada waktu bersamaan
B. reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
C. jumlah mol zat yang ada pada keadaan setimbang selalu sama
D. masing-masing zat yang bereaksi sudah habis
E. jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
JAWABAN BENAR
B.
reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
PEMBAHASAN
Kesetimbangan dinamis, yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Proses kesetimbangan dinamis ini dapat terjadi pula dalam suatu reaksi kimia.
4.
Jawablah soal berikut ini!
Pada keadaan kesetimbangan kimia, pernyataan berikut yang benar adalah....
A. mol pereaksi yang berubah sama dengan mol zat yang terbentuk
B. konsentrasi zat-zat dalam campuran reaksi tidak berubah
C. laju reaksi maju lebih cepat daripada laju reaksi balik
D. mol zat pereaksi sama dengan mol zat hasil reaksi
E. reaksi telah berganti
JAWABAN BENAR
B.
konsentrasi zat-zat dalam campuran reaksi tidak berubah
PEMBAHASAN
Pada suatu reaksi yang telah mencapai keadaan setimbang maka konsentrasi zat-zat dalam campuran reaksi tidak berubah.
5.
Jawablah soal berikut ini!
Dalam ruangan 1 liter terdapat kesetimbangan antara gas N2, H2, dan NH3 sesuai persamaan reaksi berikut.
2NH3(g) <==> N2(g) + 3H2(g)
Pada kesetimbangan tersebut terdapat 0,01 mol N2, 0,01 mol H2, dan 0,05 mol NH3. Nilai tetapan kesetimbangan reaksi adalah....
A. 2 x 10-8
B. 4 x 10-6
C. 5 x 10-8
D. 2 x 10-10
E. 2 x 10-11
JAWABAN BENAR
B.
4 x 10-6
PEMBAHASAN
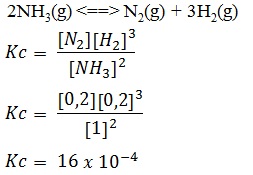
6.
Jawablah soal berikut ini!
Suatu sistem kesetimbangan bersifat dinamis-mikroskopis berarti….
A. Perubahan berlangsung terus-menerus dan dapat diamati
B. Reaksi terus berlangsung kekanan dan kekiri dan dapat diamati
C. Reaksi terus berlangsung kekanan dan kekiri tetapi tidak teramati
D. Perubahan berlangsung terus berhenti sehingga tidak dapat diukur
E. Perubahannya terhenti dan dapat terukur
JAWABAN BENAR
C.
Reaksi terus berlangsung kekanan dan kekiri tetapi tidak teramati
PEMBAHASAN
Kesetimbangan dinamis yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Jadi reaksi berlangsung kekanan dan kekiri. Bersifat dinamis-mikroskopis maksudnya hanya terjadi sedikit perubahan jadi tidak teramati.
7.
Jawablah soal berikut ini!
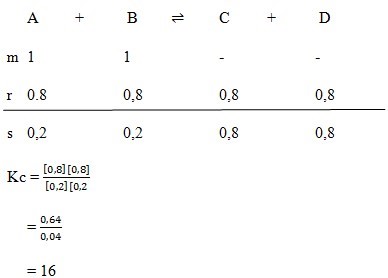
Perhatikan reaksi berikut.
A + B --> C + D
Jika satu mol A dicampur dengan satu mol B dan pada kestimbangan terdapat 0,2 mol A, tetapan kesetimbangan reaksi diatas adalah….
A. 0,4
B. 1,6
C. 4
D. 8
E. 16
JAWABAN BENAR
E.
16
PEMBAHASAN

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

