Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Kimia Unsur
MATERI
Gas Mulia

Gas Mulia
Unsur gas mulia berada pada golongan VIIIA dan terdiri dari:
- helium (He),
- neon (Ne),
- argon (Ar),
- kripton (Kr),
- xenon (Xe),
- radon (Rn).
Gas mulia mendapatkan namanya karena pada suhu ruangan, wujudnya berupa gas dan bersifat sangat stabil atau sulit bereaksi. Gas mulia sering ditemukan berupa atom tunggal di alam.
Sifat Fisis
Sifat fisis gas mulia antara lain adalah titik leleh dan titik didih yang sangat rendah. Titik didihnya mendekati nol derajat Kelvin dan titik didihnya hanya beberapa derajat di atas titik lelehnya. Gas mulia hanya akan mencair atau memadat jika energi molekul-molekulnya sangat lemah, yaitu pada suhu yang sangat rendah.
Berikut adalah sifat fisik dari unsur gas mulia:
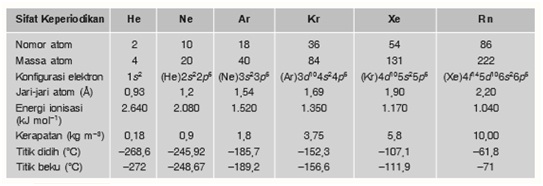
Sifat kimia
- Kulit terluarnya sudah penuh sehingga bersifat stabil.
- Gas mulia sukar bereaksi (bersifat inert) karena konfigurasi elektronnya stabil sehingga jarang ditemukan dalam bentuk senyawa.
- Sangat inert, hanya beberapa senyawa yang dapat dibentuk. Senyawa tersebut adalah XeF2, XeF4, dan XeF6.
- Gas mulia sedikit larut dalam air, kecuali helium dan neon karena ukuran atomnya terlalu kecil.
Halogen

Unsur golongan Halogen (VIIA) yang terdiri dari fluor (F), klor (Cl), brom (Br), dan iod (I), tidak pernah ditemukan dalam keadaan bebas di alam karena tingkat reaktivitasnya yang sangat tinggi.
Sifat-sifat Fisis
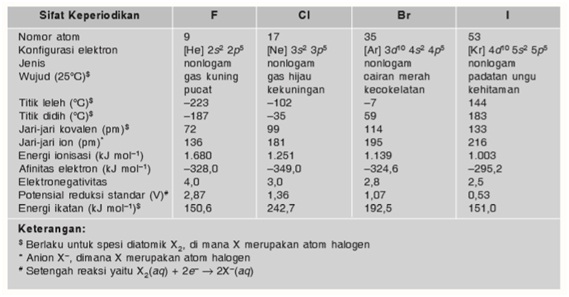
Berikut adalah sifat fisik dari unsur halogen:
- Titik didih relatif rendah karena memiliki gaya Van Der waals antar molekulnya.
- Titik didih relatif bertambah dari unsur Fluorin ke Iodin.
- Fluorin berupa gas berwarna kuning muda, klorin berupa gas berwarna hijau muda, Bromin berupa zat cair merah kecoklatan dan Iodin padatan berwarna ungu muda.
- Kelarutan dalam air berkurang dari F ke I. Iodin larut dalam KI.
- Kerapatan bertambah dari Fluorin ke Astatin.
Sifat-sifat Kimia
- Halogen bersifat reaktif. Halogen dapat bereaksi dengan logam, nonlogam, metaloid tertentu, hidrogen, dan air.
- Halogen merupakan oksidator kuat.
- Kelarutan unsur halogen berbeda-beda. Fluorin jika dilarutkan dalam air akan mengoksidasi air. Klorin dan bromin dapat larut dengan baik dalam air. Iodin sukar larut dalam air.
- Unsur halogen dapat bereaksi dengan hidrogen membentuk asam halida.
- Unsur halogen (kecuali fluorin) dapat membentuk asam-asam beroksigen (oksihalogen).
- Kekuatan asam oksihalogen yaitu HClO4 > HClO3 > HClO2 > HClO.
- Kekuatan asam halida yaitu HI > HBr > HCl > HF.
Reaksi golongan Halogen
Reaksi-reaksi halogen sebagai berikut:
Reaksi Halogen dengan Logam
Halogen bereaksi dengan semua logam dalam sistem periodik unsur membentuk halida logam.
Reaksi: 2M + nX2 ---> 2MXn, dengan M = logam; dan X = F, Cl, Br, I
Reaksi Halogen dengan Hidrogen
Halogen bereaksi dengan gas hidrogen membentuk hidrogen halide (HX).
Reaksi: H2 + X2 ---> 2HX, dengan X = F, Cl, Br, I
Reaksi Halogen dengan Halogen Lain
Halogen mempunyai molekul diatomik, maka tidaklah mengherankan jika dapat terjadi reaksi antar unsur dalam golongan halogen.
Reaksi: X2 + Y2 ---> 2XY, dengan X, Y = F, Cl, Br, I
Alkali

Unsur golongan Alkali (IA) terdiri dari litium (Li), natrium (Na), kalium (K), rubidium (Rb), sesium (Cs) dan fransium (Fr). Unsur alkali bersifat sangat reaktif, sehingga di alam tidak ditemukan sebagai unsur bebas.
Sifat-sifat Fisis
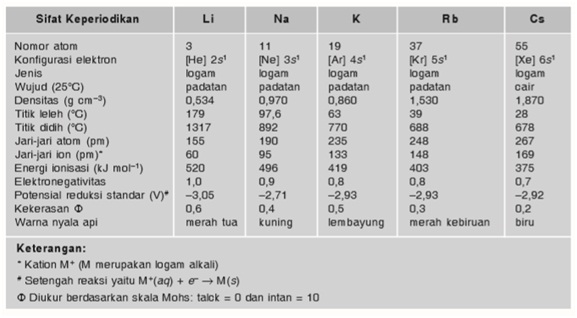
Sifat-sifat Kimia
- Dari atas ke bawah logam alkali semakin reaktif.
- Logam alkali bereaksi dengan air menghasilkan gas hidrogen.
- Reaksinya dengan oksigen menghasilkan senyawa oksida.
- Reaksi logam alkali dengan hidrogen menghasilkan senyawa hidrida.
- Sangat reaktif, sehingga di alam tidak ditemukan sebagai unsur bebas.
- Reduktor kuat, sehingga mudah teroksidasi.
Reaksi golongan Alkali
Reaksi-reaksi logam alkali sebagai berikut:
Reaksi Logam Alkali dengan Halogen
Reaksi antara logam alkali dengan halogen berlangsung sangat cepat, membentuk halida logam.
Reaksi: 2M(s) + X2 ---> 2MX(s), dengan M= logam alkali (Li, Na, K, Rb, Cs); X= halogen (F, Cl, Br, I)
Reaksi Logam Alkali dengan Hidrogen dan Nitrogen
Logam alkali bereaksi dengan gas hidrogen membentuk senyawa putih berbentuk kristal yang disebut hidrida, MH.
Reaksi: 2M(s) + H2(g) ---> 2MH(s)
Tidak semua logam alkali bereaksi dengan nitrogen, hanya litium yang membentuk litium nitrit (Li3N).
Reaksi: 6Li(s) + N2(g) ---> 2Li3N(s)
Reaksi Logam Alkali dengan Oksigen
Reaksi antara logam alkali dengan oksigen berlangsung sangat cepat. Produk yang dihasilkan berbeda, tergantung pada kondisi reaksi dan berapa banyak oksigen yang ada, seperti oksida (bilangan oksidasi O = -2), peroksida (bilangan oksidasi O = -1), dan superoksida (bilangan oksidasi O = -1/2).
- 4Li(s) + O2(g) ---> 2Li2O(s) Oksida, O= -2
- 2Na(s) + O2(g) --->Na2O2(s) Peroksida, O= -1
- K(s) + O2(g) ---> KO2(s) Superoksida, O= -1/2
Reaksi Logam Alkali dengan Air
Logam alkali bereaksi dengan air membentuk gas hidrogen dan hidroksida logam alkali, MOH
Reaksi:
- 2M(s) + 2H2O(l) ---> 2M+(aq) + 2OH-(aq) + H2(g), dengan M = Li, Na, K, Rb, Cs
Reaksi Logam Alkali dengan Amonia
Logam alkali bereaksi dengan amonia membentuk gas H2 dan logam amida (MNH2).
Reaksi:
- 2M(s) + 2NH3(l) ---> 2M+(s) + 2NH2-(s) + H2(g), dengan M = Li, Na, K, Rb, C
Reaksi Logam Alkali dengan CO2
Reaksi peroksida logam alkali dengan karbon dioksida menghasilkan garam karbonat dan oksigen.
Reaksi:
- 2MnO2(s) + 2CO(g) -->2M2CO3(s) + O2(g), dengan M = Li dan Na
Alkali Tanah

Unsur golongan Alkali Tanah (IIA) ini terdiri dari berilium (Be), magnesium (Mg), kalsium (Ca), stronsium (Sr), barium (Ba), dan radium (Ra).
Sifat-sifat Fisis

Sifat-sifat Kimia
- Sifat unsur-unsur logam alkali tanah dari atas ke bawah semakin reaktif, tetapi kurang reaktif jika dibandingkan logam alkali yang seperiode.
Reaksi golongan Alkali Tanah
Reaksi-reaksi logam alkali tanah sebagai berikut:
Logam Alkali Tanah Bereaksi dengan Halogen
Logam alkali tanah bereaksi dengan halogen membentuk garam halide (MX2)
Reaksi:
- M + X2 ---> MX2, dengan: M = Be, Mg, Ca, Sr, Ba; X = F, Cl, Br, I
Logam Alkali Tanah Bereaksi dengan Oksigen
Logam alkali tanah bereaksi dengan oksigen membentuk oksida (MO).
Reaksi:
- 2M + O2 ---> 2MO, dengan: M = Be, Mg, Ca, Sr, Ba
Logam Alkali Tanah Bereaksi dengan Air
Logam alkali tanah bereaksi dengan air membentuk logam hidroksida [M(OH)2]
Reaksi:
- M(s) + 2H2O(l) ---> M2+(aq) + 2OH-(aq) + H2(g), kecuali Berilium tidak bereaksi dengan air.
Nitrogen dan Oksigen

Nitrogen
Nitrogen adalah unsur kimia dalam tabel periodik yang memiliki lambang N dan nomor atom 7. Biasanya ditemukan sebagai gas tanpa warna, tanpa bau, tanpa rasa dan merupakan gas diatomik bukan logam yang stabil, sangat sulit bereaksi dengan unsur atau senyawa lainnya.
Sifat Fisis Nitrogen
- Berupa gas diatomik N2 tidak berbau, tidak berasa, tidak berwarna, dan sedikit larut dalam air.
- Bersifat non polar sehingga gaya Van Der Waals antar molekul sangat kecil
- Sifat fisik nitrogen yang lain
- Titik didih 77,36 K
- Titik lebur 63,15 K
- Berat jenis relatif 0,97
- Berat molekul 28,013
- Kalor peleburan 0,720 kJ/mol
- Kalor penguapan 5,57 kJ/mol
- Kapasitas kalor dalam suhu kamar 29,124 J/mol K
Sifat Kimia Nitrogen
Adapun sifat kimia nitrogen antara lain seperti berikut.
- Nitrogen merupakan unsur yang stabil (kurang reaktif). Dalam keadaan bebas, nitrogen merupakan molekul diatomik dengan ikatan kovalen rangkap 3. kestabilan molekul nitrogen didukung oleh besarnya energi disosiasi ikatan.
- Pada suhu rendah, nitrogen sukar bereaksi dengan unsur lain, hanya logam litium yang dapat bereaksi dengan nitrogen.
N2(g) + 6Li(s) --> 2Li3N(s) - Pada suhu tinggi, nitrogen dapat bereaksi dengan unsur non logam, beberapa logam alkali dan alkali tanah.
N2(g) + O2(g) --> 2NO(g)
6Mg(s) + 2N2(g) --> 2Mg3N2(s)
Oksigen
Oksigen adalah unsur kimia dalam sistem tabel periodik yang mempunyai lambang O dan nomor atom 8. Ia merupakan unsur golongan kalkogen dan dapat dengan mudah bereaksi dengan hampir semua unsur lainnya (utamanya menjadi oksida).
Sifat Fisis Oksigen
- Massa atom relatif 15,9944 g/mol
- Jari-jari atom 60 pm
- Titik Beku -218,9oC
- Titik leleh -182,9oC
- Potensial Elektroda +0,401
- Massa jenis (0oC; 101,325 kPa) 1,429 g/L
- Sifat magnetik Paramagnetik
Sifat Kimia Oksigen
Oksigen merupakan unsur yang reaktif. Dalam keadaan bebas, unsur ini terdapat dalam dua bentuk molekul, yaitu molekul oksigen diatomik (O2) dan bentuk alotropinya, yaitu molekul triatomik yang dikenal dengan ozon (O3). Oksigen dapat bersenyawa dengan berbagai unsur. Oksigen yang bersenyawa dengan unsur lain dikenal dengan nama oksida. Oksigen merupakan gas yang mempunyai peran dalam proses pembakaran (unsur pembakar).
Periode Tiga

Unsur Periode Ketiga terdiri dari natrium (Na), magnesium (Mg), aluminium (Al), silikon (Si), fosfor (P), belerang (S), klor (Cl), dan argon (Ar).
Sifat Unsur Periode Ketiga
Sifat logam dan nonlogam
- logam: Na, Mg, dan Al.
- semilogam: Si.
- nonlogam: P, S, Cl, dan Ar.
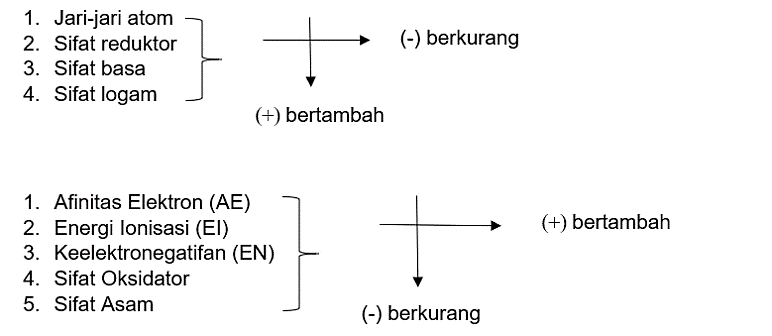
Sifat keperiodikan
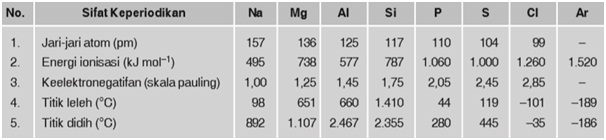
Sifat reduktor dan oksidator
Unsur-unsur periode ketiga semakin ke kanan semakin mudah mengalami reaksi reduksi. Oleh karenanya, sifat oksidatornya semakin bertambah dan sifat reduktornya semakin berkurang.
Sifat hantar listrik
Na, Mg, dan Al dapat menghantarkan listrik. Sedangkan P, S, Cl, dan Ar tidak dapat menghantarkan listrik,
Sifat asam basa
Unsur-unsur periode ketiga semakin ke kanan sifat basanya semakin berkurang dan sifat asamnya semakin bertambah.
Unsur Golongan Transisi

Sifat Golongan Transisi
Pada sistem periodik unsur, yang termasuk dalam golongan transisi adalah unsur-unsur golongan B, dimulai dari IB hingga VIIIB.
Sifat logam
- Semua unsur transisi adalah logam, yang bersifat lunak, mengkilap, dan penghantar listrik dan panas yang baik.
- Unsur logam transisi lebih keras, punya titik leleh, titik didih, dan kerapatan lebih tinggi.
Bilangan oksidasi
- Unsur transisi mempunyai beberapa bilangan oksidasi.
- Unsur-unsur transisi periode empat bersifat elektropositif (mudah melepaskan elektron) sehingga bilangan oksidasinya bertanda positif.
Sifat kemagnetan
- Diamagnetik: Unsur transisi yang menolak medan magnet. Sifat ini dimiliki oleh unsur transisi yang seluruh elektron pada orbital d telah berpasangan.
Contoh: unsur Zn - Paramagnetik: Unsur transisi yang sedikit dapat ditarik medan magnet. Sifat ini dimiliki oleh unsur transisi yang memiliki elektron tidak berpasangan pada orbital d.
Contoh: unsur Sc - Feromagnetik: Unsur transisi yang dapat ditarik dengan sangat kuat oleh medan magnet. Sifat ini dimiliki oleh unsur transisi dimana 3 atau 4 elektron pada orbital d tidak berpasangan.
Contoh: unsur Fe, Co, dan Ni
Ion berwarna
- Senyawa yang dibentuk dari ion-ion logam transisi sebagian besar berwarna.
- Warna ini disebabkan oleh tingkat energi elektron pada unsur-unsur transisi hampir sama dimana subkulit 3d yang belum terisi penuh menyebabkan elektron pada subkulit itu menyerap energi cahaya, sehingga elektronnya tereksitasi dan memancarkan energi cahaya dengan warna yang sesuai dengan warna cahaya yang dapat dipantulkan pada saat kembali ke keadaan dasar.
Dapat membentuk ion kompleks/senyawa koordinasi
- Unsur transisi dapat membentuk ion kompleks karena memiliki orbital-orbital yang masih kosong.
Contoh nama senyawa kompleks:
[Ag(NH3)2]Cl : diamin perak(I) klorida
Na2[Cu(OH)4] : natrium tetrahidrokso kuprat(II)
Tata Nama Senyawa Kompleks

Tata nama senyawa kompleks
Salah satu ciri penting dari logam transisi adalah kemampuannya membentuk kompleks atau senyawa koordinasi, dimana atom atau ion logam pusatnya mempunyai dua atau lebih ligan (zat penyepit) terikat padanya oleh ikatan kovalen koordinasi.
Dengan komponennya antara lain:
- Senyawa kompleks = ion kompleks + kation atau anion
- Ion kompleks = atom pusat (unsur transisi) + ligan
Ligan adalah suatu ion atau molekul yang memiliki sepasang elektron atau lebih yang dapat disumbangkan. Ligan dapat berupa anion atau molekul netral.
Berikut ini beberapa contoh ligan antara lain:
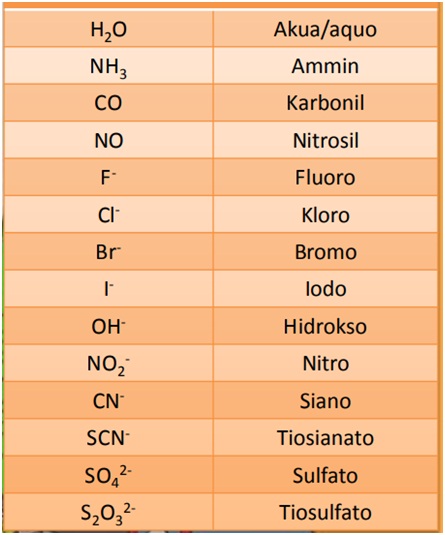
Adanya ion kompleks dalam senyawa biasa ditandai dengan adanya kurung kapital dalam penulisan rumus molekul senyawa kompleks.
Contoh:
[Ag(NH3)2]Cl dan K4[Fe(CN)6]
Setelah belajar tentang senyawa kompleks sekarang kita coba pelajari bagaimana tata namanya.
Tata nama senyawa kompleks memiliki aturan sebagai berikut:
- Penamaan kation mendahului anion; sama seperti penamaan senyawa ionik pada umumnya.
- Nama ion kompleks tersusun dari nama ligan dan nama atom pusat yang dituliskan serangkai sebagai satu kata. Ligan disebutkan mendahului atom pusat.
- Jumlah ligan diawali dengan awalan angka yunani: mono = 1; di = 2; tri = 3; tetra = 4; penta = 5; heksa = 6, dst. Jika ligan lebih dari sejenis, ligan-ligan disebutkan menurut abjad (misal: akua mendahului kloro). nama-nama ligan dapat dilihat pada tabel berikut, ligan yang berupa anion selalu dinamai dengan akhiran -o.
- Jika ion kompleks merupakan kation (bermuatan positif), atom pusat memakai nama indonesia.
- Jika ion kompleks merupakan anion (bermuatan negatif), atom pusat memakai nama latin dengan akhiran -at.
- Nama atom pusat, baik indonesia maupun latin, harus segera diikuti oleh bilangan oksidasi atom pusat memakai angka romawi dalam tanda kurung.
Contoh:
[Ag(NH3)2]Cl = diamin perak (I) klorida
K4[Fe(CN)6] = kalium heksasiano ferrat (III)
1.
Perhatikan data berikut!
Berikut ini data sifat-sifat unsur periode ketiga dari Na sampai dengan Cl
- Sifat logam bertambah
- Sifat non logam bertambah
- Energi ionisasi berkurang
- Sifat asam bertambah
- Keelektronegatifan berkurang
- Jari-jari atom berkurang
- Sifat basa bertambah
Perubahan sifat yang benar dari Na sampai dengan Cl adalah...
A. 1,3 dan 4
B. 2,3 dan 4
C. 2,4 dan 6
D. 2,4 dan 7
E. 4,5 dan 6
JAWABAN BENAR
C.
2,4 dan 6
PEMBAHASAN
Perubahan Sifat Na sampai dengan Cl:
- Sifat logam berkurang
- Sifat non logam bertambah
- Energi ionisasi bertambah
- Sifat asam bertambah
- Keelektronegatifan bertambah
- Jari-jari atom berkurang
- Sifat basa berkurang
2.
Jawablah soal berikut ini!
Dalam periode ketiga, unsur yang termasuk dalam semilogam adalah....
A. Na
B. Al
C. Si
D. Cl
E. Ar
JAWABAN BENAR
C.
Si
PEMBAHASAN
- logam: Na, Mg, dan Al.
- semilogam: Si.
- nonlogam: P, S, Cl, dan Ar.
3.
Jawablah soal berikut dengan benar!
Sifat paramagnetik dari unsur transisi ditentukan oleh banyaknya....
A. Elektron tunggal pada orbital f
B. Elektron tunggal pada orbital p
C. Elektron tunggal pada orbital d
D. Pasangan elektron pada orbital p
E. Pasangan elektron pada orbital d
JAWABAN BENAR
C.
Elektron tunggal pada orbital d
PEMBAHASAN
Sifat paramagnetik adalah sifat dimana unsur dapat ditarik oleh magnet. Sifat ini banyak dimiliki oleh unsur-unsur transisi karena adanya elektron bebas/tunggal di orbital d sehingga mudah diinduksi oleh medan magnet. Semakin banyak orbital yang hanya berisi elektron tunggal semakin kuat diinduksi oleh medan magnet.
4.
Jawablah soal berikut dengan benar!
Pada golongan gas mulia, unsur yang mempunyai energi ionisasi terbesar adalah....
A. He
B. Ne
C. Ar
D. Kr
E. Xe
JAWABAN BENAR
A.
He
PEMBAHASAN
Pada keperiodikan unsur segolongan, bahwa dalam satu golongan dari atas ke bawah jari-jari atom semakin panjang,sehingga semakin mudah melepaskan elektron. Akibatnya energi yang diperlukan untuk melepas elektron (energi ionisasi) semakin kecil. Jadi, unsur golongan gas mulia yang memiliki energi ionisasi terbesar adalah yang paling atas, yaitu He.
5.
Jawablah soal berikut!
Aluminium dapat bereaksi dengan asam atau basa kuat. Jika bereaksi dengan asam kuat akan terbentuk ion....
A. Al3+
B. Al2+
C. AlO-
D. Al2O3-
E. AlO2-
JAWABAN BENAR
D.
Al2O3-
PEMBAHASAN
Aluminium jika bereaksi dengan asam kuat akan terbentuk ion Al2O3-.
6.
Jawablah soal berikut!
Rumus kimia ion kompleks tetraamin diklorokobalt(III) adalah….
A. [Co(NH3)4Cl2]3+
B. [Co(NH3)4Cl2]+
C. [Co(NH3)4Cl2]2+
D. [Co(NH3)4Cl2]-
E. [Co(NH3)4Cl2]2-
JAWABAN BENAR
B.
[Co(NH3)4Cl2]+
PEMBAHASAN
tetraamin = 4 buah ligan NH3
dikloro = 2 buah ligan Cl-
Atom pusat = kobalt (III) = Co3+
Rumus kimia ion tetraamin diklorokobalt (III): 4NH3 + 2Cl- + Co3+ -->[Co(NH3)4Cl2]+
7.
Kerjakan soal berikut dengan tepat!
Sifat yang sesuai untuk unsur golongan II A terhadap unsur golongan I A adalah….
A. jari-jari atom lebih besar
B. sifat basa lebih kuat
C. energi ionisasi lebih kecil
D. sifat reduktor lebih lemah
E. titik leleh lebih rendah
JAWABAN BENAR
D.
sifat reduktor lebih lemah
PEMBAHASAN

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

