Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Reaksi Redoks dan Elektrokimia
MATERI
Pengertian Sel Elektrokimia

Sel elektrokimia adalah tempat terjadinya aliran elektron yang ditimbulkan oleh konversi energi kimia menjadi energi listrik atau sebaliknya. Hal ini dimungkinkan dengan pemisahan reaksi oksidasi dan reaksi reduksi (reaksi redoks).
Sel elektrokimia adalah suatu alat yang menghasilkan arus listrik dari energi yang dihasilkan oleh reaksi di dalam selnya, yaitu reaksi oksidasi dan reaksi reduksi (reaksi redoks). Sel elektrokimia tersusun dari dua material penghantar atau konduktor listrik yang disebut dengan katoda dan anoda. Kedua material penghantar ini disebut dengan elektroda.
Anoda merupakan elektroda tempat terjadinya reaksi oksidasi, sedangkan katoda adalah elektroda tempat terjadinya reaksi reduksi. Reaksi oksidasi adalah reaksi yang menghasilkan kenaikan bilangan oksidasi, sedangkan reaksi reduksi adalah reaksi yang menghasilkan penurunan bilangan oksidasi.
Bilangan oksidasi menunjukkan jumlah total elektron yang telah dipindahkan dari suatu unsur (hal ini akan menghasilkan bilangan oksidasi positif) dan jumlah total elektron yang telah ditambahkan ke dalam suatu unsur (menghasilkan bilangan oksidasi negatif) untuk mencapai keadaan yang baru.
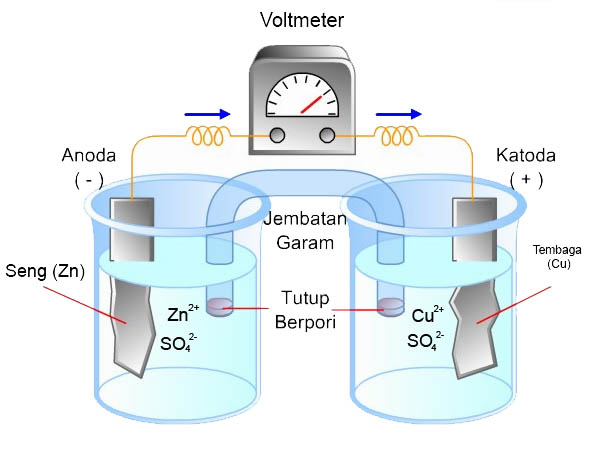
Skema Sel Daniell
Sel Daniell adalah sel elektrokimia yang menggunakan seng (Zn) sebagai anoda dan tembaga (Cu) sebagai katoda. Seng dicelupkan ke dalam seng sulfat (ZnSO4), sedangkan tembaga dicelupkan ke dalam tembaga sulfat (CuSO4).
Sel Volta

Sel Volta
Sel volta (sel galvani) adalah sel elektrokimia dimana energi kimia dari reaksi redoks spontan diubah menjadi energi listrik. Prinsip kerja sel volta dalam menghasilkan arus listrik adalah aliran transfer elektron dari reaksi oksidasi di anode ke reaksi reduksi di katode melalui rangkaian luar.
Susunan Sel Volta
Secara umum, sel volta tersusun dari:
- Anode, yaitu elektrode tempat terjadinya reaksi oksidasi.
- Katode, yaitu elektrode tempat terjadinya reaksi reduksi.
- Elektrolit, yaitu zat yang dapat menghantarkan listrik.
- Rangkaian luar, yaitu kawat konduktor yang menghubungkan anode dengan katode.
- Jembatan garam, yaitu rangkaian dalam yang terdiri dari larutan garam. Jembatan garam memungkinkan adanya aliran ion-ion dari setengah sel anode ke setengah sel katode, dan sebaliknya sehingga terbentuk rangkaian listrik tertutup.
Notasi sel volta digunakan untuk menggambarkan rangkaian sel volta dan reaksi redoks yang berlangsung didalamnya. Sel Volta tersusun atas setengah sel antara logam seng-ion seng dan setengah sel antar logam tembaga-ion tembaga. Sel tersebut dapat dinyatakan dengan notasi yang ditulis dalam bentuk:
Zn(s)|Zn2+(aq)||Cu2+(aq)|Cu(s)
Notasi tersebut dinamakan notasi sel volta.
Secara umum, penulisan notasi sel volta menurut konvensi IUPAC adalah sebagai berikut.
- Notasi sel terdiri dari anode dan katode
- Tanda || adalah jembatan garam untuk memisahkan fase berbeda.
- Tanda | adalah batas fase untuk memisahkan fase berbeda.
- Tanda koma (,) digunakan untuk memisahkan spesi-spesi dalam fase yang sama.
- Elektroda anode terletak paling kiri dan elektrode katode paling kanan.
- Elektrolit inert tidak ditulis
Potensial elektrode standar (Eo), adalah potensial elektrode (potensial reduksi) yang diukur pada suhu 25oC dan tekanan parsial 1 atm, dimana konsentrasi ion-ion yang terlibat dalam reaksi adalah 1 M. Potensial elektrode standar dapat digunakan untuk memperkirakan apakah suatu reaksi redoks berlangsung secara spontan atau tidak.
Potensial sel adalah kemampuan maksimum sel untuk mendorong elektron mengalir melalui rangkaian luar. Sel volta digolongkan menjadi sel primer, sel sekunder dan bahan bakar.
Reaksi kimia yang menghasilkan energi listrik:
Katode : kutub (+)
Anode : kutub (-)
Potensial listrik yang dihasilkan sel Volta disebut potensial sel (Eosel).
Reaksi berlangsung spontan bila besarnya Eosel = positif (+).
Eosel = Eo reduksi - Eo oksidasi
Deret Keaktifan Logam (Deret Volta)
Urutan unsur-unsur logam pada tabel potensial elektroda standar disebut juga deret elektrokimia (deret volta). Deret ini memberikan informasi reaktivitas unsur logam dalam suatu reaksi redoks.
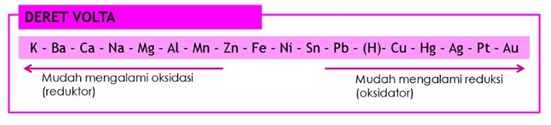
- Reaktivitas unsur logam semakin berkurang dari kiri ke kanan.
- Sifat reduktor (daya reduksi) logam semakin berkurang dari kiri ke kanan.
- Kecenderungan logam untuk teroksidasi semakin berkurang dari kiri ke kanan.
- Sifat oksidator (daya oksidasi) logam semakin bertambah dari kiri ke kanan.
- Kecenderungan ion logam untuk tereduksi semakin bertambah dari kiri ke kanan.
Sel Elektrolisis

Sel Elektrolisis
Sel elektrolisis adalah sel elektrokimia dimana energi listrik digunakan untuk menjalankan reaksi redoks yang tidak spontan. Elektrolisis adalah peristiwa penguraian zat elektrolit oleh arus listrik searah. Elektroda positif (+) yang disebut juga anoda sedangkan elektroda negatif (-) disebut katoda.
Susunan Sel Elektrolisis
Secara umum, sel elektrolisis tersusun dari:
- Sumber listrik yang menyuplai arus searah (dc), misalnya baterai.
- Anode, yaitu elektrode tempat terjadinya reaksi oksidasi.
- Katode, yaitu elektrode tempat terjadinya reaksi reduksi.
- Elektrolit, yaitu zat yang dapat menghantarkan listrik.
Reaksi kimia yang memerlukan energi listrik:
Katode : kutub (-)
Anode : kutub (+)
Elektrolisis leburan/lelehan/cairan: unsur-unsur yang terlibat dalam reaksi adalah kation, anion dan elektrodenya.
Elektrolisis larutan: unsur-unsur yang terlibat dalam reaksi adalah kation, anion, pelarut (air), dan elektrodenya.
Skema reaksi-reaksi elektrolisis larutan:
- Reaksi di katode bergantung pada jenis kation
jika kation merupakan logam aktif (golongan IA, IIA, Al, dan Mn), maka terjadi reduksi air:
2H2O(l) +2e- --> H2(g) + 2OH-(aq)
jika kation bukan logam aktif, maka reaksi reduksi:
2H+(aq) + 2e- --> H2(g)
Lx+(aq) + xe- --> L(s) -
Reaksi di anode bergantung pada jenis anode dan anion
jika anode merupakan anode inert (Pt, Au, C) dan anionnya merupakan sisa asam oksidasi (seperti SO42- atau NO3-), maka terjadi oksidasi air:
2H2O(l) --> 4H+(aq) + O2(g) + 4e-
jika anode merupakan anode inert (Pt, Au, C) dan anionnya merupakan sisa asam lain (seperti Cl-, Br-, I-) atau OH-, maka reaksi oksidasi:
2Cl-(aq) --> Cl2(g) + 2e-
4OH-(aq) --> 2H2O(l) + O2(g) + 4e-
jika anode bukan merupakan anode inert, maka anode mengalami oksidasi:
M(s) --> My+(aq) + ye-
Logam aktif (golongan IA, IIA, Al dan Mn) kationnya akan tereduksi menjadi logamnya, bila yang dielektrolisis adalah lelehan/leburan/cairanya
Pada pelapisan/penyepuhan logam yang digunakan sebagai anode adalah logam pelapis
Susunan Sel Elektrolisis:
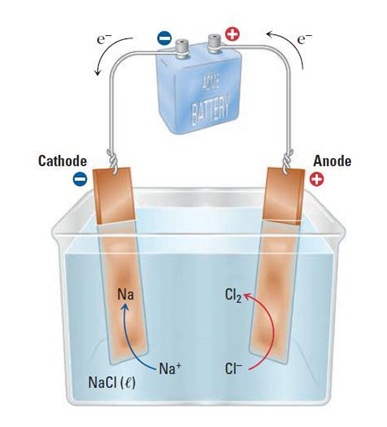
Reaksi yang terjadi:
Katode (-): 2H2O(l) +2e- --> H2(g) + 2OH-(aq)
Anode (+): 2Cl-(aq) --> Cl2(g) + 2e-
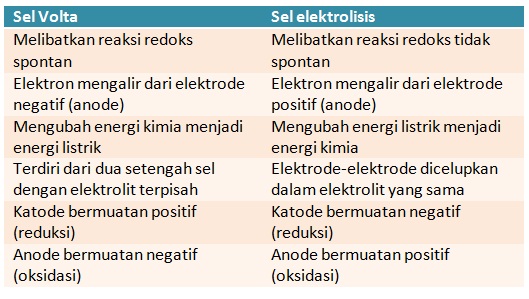
Persamaan dan Perbedaan Sel Volta dengan Sel Elektrolisis

Persamaan sel volta dengan sel elektrolisis
Sel Volta dan Sel Elektrolisis termasuk dari Sel Elektrokimia, dibawah ini merupakan persamaan dari Sel Volta dan Sel Elektrolisis:
- Reaksi oksidasi berlangsung di anode dan reaksi reduksi berlangsung di katode
- Pada rangkaian luar, elektron mengalir melalui kawat dari anode ke katode.
- Elektrolit merupakan zat yang menghantarkan listrik di dalam sel. Arus listrik dibawa oleh anion ke anode dan oleh kation ke katode.
Perbedaan sel volta dengan sel elektrolisis
Sobat Pintar, di bawah ini merupakan tabel perbedaan antara Sel Volta dengan Sel Elektrolisis:
Hukum Faraday

Hukum Faraday I
Massa zat yang dihasilkan pada suatu elektrode selama elektrolisis (G) berbanding lurus dengan jumlah muatan listrik yang digunakan (Q).
Secara matematis, hukum Faraday I dapat ditulis dalam persamaan berikut:
G ~ Q
Sebagaimana jumlah muatan listrik (Q) sama dengan hasil kali dari kuat arus listrik (i) dengan selang waktu (t),
Q = i x t
G ~ i x t
Massa zat yang dihasilkan selama elektrolisis (G) juga berbanding lurus dengan kuat arus (i) dan selang waktu (t).
Muatan listrik (Q) yang digunakan dalam elektrolisis berbanding lurus dengan jumlah mol elektron yang terlibat dalam reaksi redoks (ne). Secara eksperimen diperoleh bahwa 1 mol elektron memiliki muatan listrik sebesar 96.500 coulomb. Nilai muatan listrik elektron ini ditetapkan sebagai konstanta Faraday (F). Jadi, hubungan ini dapat dirumuskan sebagai berikut.
Q = ne x F
Hukum Faraday II
Massa zat yang dihasilkan pada elektrode berbanding lurus dengan massa ekivalen zat.
Di dalam Hukum Faraday II dinyatakan bahwa massa yang dihasilkan pada elektrode berbanding lurus dengan massa ekivalen zat.
massa zat ~ massa ekivalen zat
w ~ ME
Massa ekivalen zat adalah massa atom relatif (Ar) dibagi dengan perubahan bilangan oksidasinya atau muatan ionnya.
ME = Ar/biloks atau muatan ion
Penggunaan Sel Volta dan Sel Elektrolisis

Berikut ini adalah penggunaan sel volta:
- Dimanfaatkan dalam baterai (sel kering)
- Dimanfaatkan dalam aki (sel basah)
- Untuk sel bahan bakar
Berikut ini adalah penggunaan sel elektrolisis:
- Untuk memproduksi suatu zat
- Untuk pemurnian logam, dengan prinsip:
- logam kotor sebagai anode
- logam murni sebagai katode. - Untuk penyepuhan (elektroplating), dengan prinsip;
- Logam yang akan disepuh sebagai katode
- Logam penyepuh sebagai anode
Elektrolit yaitu larutan yang mengandung ion logam penyepuh. massa logam penyepuh akan berkurang.
1.
Jawablah soal berikut dengan benar!
Sel elektrokimia dimana energi kimia dari reaksi redoks spontan diubah menjadi energi listrik adalah pengertian dari.....
A. potensial sel
B. notasi sel
C. deret volta
D. sel volta
E. sel elektrokimia
JAWABAN BENAR
D.
sel volta
PEMBAHASAN
sel elektrokimia dimana energi kimia dari reaksi redoks spontan diubah menjadi energi listrik adalah pengertian dari sel volta.
2.
Jawablah soal berikut dengan benar!
Diketahui:
Ag+ + e- ---> Ag E0=+0,80 volt
Mg2+ + 2e- ---> Mg E0 = -2,38 volt
Potensial standar sel Ag dan Mg adalah..
A. +0,80 volt
B. -2,38 volt
C. +2,38 volt
D. -0,80 volt
E. +3,18 volt
JAWABAN BENAR
E.
+3,18 volt
PEMBAHASAN
Ag+ + e- ---> Ag E0=+0,80 volt
Mg2+ + 2e- ---> Mg E0 = -2,38 volt
Esel = E0katoda-Eanoda
Esel = +0,80-(-2,38) = +3,18 volt
3.
Jawablah soal berikut dengan benar!
Perhatikan sel elektrokimia berikut ini!
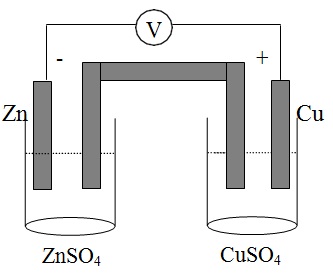
Penulisan diagram yang tepat dari gambar adalah.....
A. Zn|Zn2+||Cu2+|Cu
B. Cu|Cu2+||Zn2|Zn
C. Zn2+|Zn||Cu|Cu2+
D. Cu2+|Cu||Zn2+|Zn
E. Zn|Zn2+||Cu|Cu2+
JAWABAN BENAR
A.
Zn|Zn2+||Cu2+|Cu
PEMBAHASAN

Cu di kanan dan Zn di kiri. Maka notasi sel adalah Zn|Zn2+||Cu2+|Cu, Zn teroksidasi (biloks naik) sedangkan Cu tereduksi (biloks turun).
4.
Jawablah soal berikut dengan benar!
Dalam suatu sel volta terjadi reaksi ;
Sn + 2Ag+ --> Sn2+ + 2Ag
E0 Sn2+|Sn E0 = -0,14 volt
E0 Ag+|Ag E0 = +0,80 volt
harga potensial sel reaksi tersebut adalah….
A. 1,88 volt
B. 1,74 volt
C. 0,94 volt
D. 0,36 volt
E. -0,94 volt
JAWABAN BENAR
C.
0,94 volt
PEMBAHASAN
Potensial pada sel volta selalu positif maka potensial besar - potensial kecil
E0 sel= E0 red - E0 oks
= 0,8 - (-0,14)
= 0,94 volt
5.
Jawablah soal berikut dengan benar!
Arus listrik 20 ampere dialirkan ke dalam larutan AgNO3 selama 965 detik. Massa perak yang dihasikan di katoda adalah ..... gram. (Ar Ag=108; 1F = 96500 C/mol)
A. 5,4
B. 10,8
C. 21,6
D. 54
E. 108
JAWABAN BENAR
C.
21,6
PEMBAHASAN
Gunakan Hukum I Faraday, Biloks Ag dalam senyawa adalah +1.
e = Ar/biloks.
W = e . i. t/96500
= 108/1 . 20. 965/96500
= 21,6 gram
6.
Jawablah soal berikut dengan benar!
Bahan yang digunakan sebagai elektrode pada sel aki (accu) adalah …
A. Pt dan C
B. Zn dan C
C. Pb dan PbO2
D. Zn dan Cu
E. Cu dan PbO2
JAWABAN BENAR
C.
Pb dan PbO2
PEMBAHASAN
Aki merupakan sel yang banyak kita jumpai karena banyak digunakan pada sepeda motor maupun mobil. Aki temasuk sel sekunder, karena selain menghasilkan arus listrik, aki juga dapat diisi arus listrik kembali. Secara sederhana Sesuai prinsip pada sel Volta, aki merupakan sel yang terdiri dari elektrode Pb sebagai anode dan PbO2 sebagai katode dengan elektrolit H2SO4.
7.
Jawablah soal berikut dengan benar!
Logam yang tidak diperoleh dengan proses elektrolisis adalah …
A. Natrium
B. Aluminium
C. Magnesium
D. Kalsium
E. Merkuri
JAWABAN BENAR
E.
Merkuri
PEMBAHASAN
Logam-logam Natrium, Aluminium, Magnesium, dan Kalsium diperoleh dengan proses elektrolisis, sebab logam-logam ini tergolong reduktor kuat. Logam Merkuri (Raksa) adalah logam yang berwujud cair pada suhu kamar, tidak diendapkan di Katode. Logam ini diperoleh dengan Pemanggangan HgS atau pemanasan HgO. Reaksinya :
HgS + O2 --> Hg + SO2
2HgO --> 2Hg + O2

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

