Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Reaksi Reduksi Oksidasi dan Tata Nama Senyawa
MATERI
Pengertian dan Aturan Bilangan Oksidasi

Bilangan oksidasi senyawa adalah jumlah muatan listrik yang dimiliki atom-atom suatu senyawa, dimana elektron ikatan didistribusikan ke atom yang lebih elektronegatif.
Bilangan oksidasi atom adalah muatan listrik yang dimiliki suatu atom dalam sebuah senyawa.
Contoh: biloks HCl adalah 0, biloks Mg2+ adalah +2, dan biloks F- adalah -1.
Penentuan bilangan oksidasi/biloks atom:
- Unsur bebas di alam memiliki biloks 0.
Contoh: H2, N2, O2, P4, S8, Fe, Mn, Ca. - Ion memiliki biloks yang sama dengan nilai muatannya.
Contoh: ion CO32- memiliki biloks -2, ion Ca2+ memiliki biloks +2. - Unsur logam memiliki biloks positif.
Nilai-nilai biloks logam:
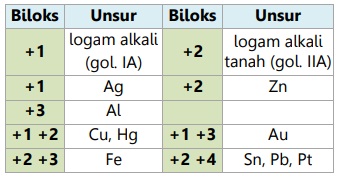
- Unsur fluor (F) selalu memiliki biloks -1.
- Unsur hidrogen (H) memiliki biloks:
Biloks umum H adalah +1.
Contoh: dalam HCl dan H2SO4.
Pada hidrida logam, H memiliki biloks -1.
Contoh: Dalam NaH. - Unsur oksigen (O) memiliki biloks:
Pada senyawa oksida atau umum (mengandung ion O2-).
Contoh: Pada K2O, H2O, Na2O dan MgO.
Pada senyawa peroksida (mengandung ion O22-), oksigen memiliki biloks -1.
Contoh: Pada K2O2, H2O2, Na2O2 dan MgO2.
Pada senyawa superoksida (mengandung ion O2-), oksigen memiliki biloks -1/2.
Contoh: Pada KO2, HO2, NaO2 dan MgO4, biloks oksigen -1/2.
Pada senyawa F2O, oksigen memiliki biloks +2. - Total biloks atom penyusun suatu senyawa:
Pada senyawa netral, total biloks atom penyusun adalah 0.
Pada senyawa ion, total biloks atom penyusun sama dengan muatan ionnya.
Contoh:
Tentukan bilangan oksidasi unsur S pada Na2SO4!
Jawab:
Biloks Na = +1, biloks O = -2.
Total biloks menjadi:
2(b.o. Na) + (b.o. S) + 4(b.o. O) = 0
2(1) + b.o. S + 4(-2) = 0
b.o. S = 8 – 2 = 6
Penentuan Reduksi Oksidasi

Suatu reaksi tergolong reaksi redoks atau bukan dapat dilakukan dengan mengecek bilangan oksidasi masing-masing atom tiap senyawa yang terlibat dalam reaksi.
Tahapan menentukan reaksi redoks:
- Reaksi yang melibatkan unsur bebas umumnya tergolong reaksi redoks.
- Reaksi yang melibatkan unsur yang berganti tipe rumus harus diperiksa biloksnya.
- Oksidator, reduktor, hasil oksidasi, dan hasil reduksi dapat ditentukan setelah seluruh atom tiap senyawa yang terlibat dalam reaksi diperiksa bilangan oksidasinya, apakah bertambah atau menurun.
Contoh:
Tentukan apakah reaksi berikut merupakan reaksi redoks atau bukan! Bila iya, tentukan oksidator, reduktor, hasil oksidasi, dan hasil reduksi!
2CuSO4 + 4KI --> 2CuI + I2 + 2K2SO4
Jawab:
Karena ada senyawa bebas (I2), maka reaksi tergolong reaksi redoks.
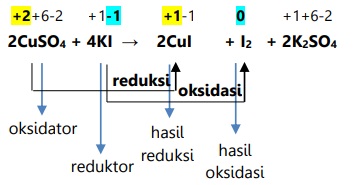
Setelah diperiksa satu persatu, atom Cu pada CuSO4 mengalami reduksi karena penurunan biloks, dan atom I pada KI mengalami oksidasi karena kenaikan biloks.
Disproporsionasi dan Konproporsionasi

Reaksi disproporsionasi atau autoredoks adalah reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama. Dalam kata lain, zat tersebut mengalami reduksi dan juga oksidasi.
Contoh:
Reaksi natrium hipoklorit
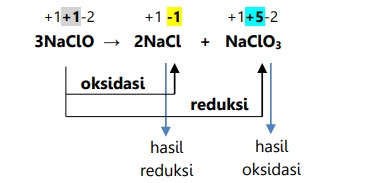
Reaksi konproporsionasi adalah reaksi redoks yang hasil oksidasi dan reduksinya merupakan zat yang sama.
Contoh:
Reaksi hidrogen sulfida dengan belerang dioksida.
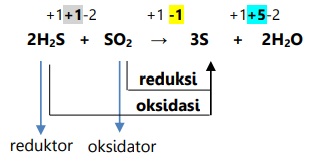
1.
Harga bilangan oksidasi atom S dalam H2SO4 adalah....
A. -6
B. -3
C. -2
D. 0
E. +6
JAWABAN BENAR
E.
+6
PEMBAHASAN
H = +1
O = -2
2(+1) + S + 4(-2) = 0
+2 + S + (-8) = 0
S = +6
2.
Perhatikan reaksi berikut!
C6H12O6(s) + 6O2(g) --> 6CO2(g) + 6H2O(l)
dari reaksi diatas yang bertindak sebagai oksidator adalah...
A. C6H12O6
B. O2
C. CO2
D. H2O
E. H2
JAWABAN BENAR
B.
O2
PEMBAHASAN
C6H12O6(s) + 6O2(g) --> 6CO2(g) + 6H2O(l)
Oksigen (O2) mengalami reduksi, sehingga ia adalah oksidator.
3.
Bilangan oksidasi Cl dalam senyawa KClO2 adalah....
A. -1
B. +5
C. +1
D. +7
E. +3
JAWABAN BENAR
E.
+3
PEMBAHASAN
KClO2 = 0
K = +1
O = -2
(+1) + Cl + 2(-2) = 0
Cl = +3
4.
Bilangan oksidasi hidrogen = –1 terdapat pada senyawa ....
A. NH3
B. HNO3
C. NaH
D. H2O
E. PH3
JAWABAN BENAR
C.
NaH
PEMBAHASAN
NaH = 0
Na = +1
H = -1
5.
Di antara senyawa-senyawa mangan di bawah ini, yang manakah mangan mempunyai bilangan oksidasi tertinggi adalah ....
A. MnO2
B. KMnO4
C. K2MnO4
D. MnO
E. MnCl2
JAWABAN BENAR
B.
KMnO4
PEMBAHASAN
- MnO2
Mn = +4 - KMnO4
Mn = +7 - K2MnO4
Mn = +6 - MnO
Mn = +2 - MnCl2
Mn = +2

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

