Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Reaksi Reduksi Oksidasi dan Tata Nama Senyawa
MATERI
Redoks Berdasarkan Pengikatan dan Pelepasan Oksigen

Menurut konsep ini:
- Oksidasi adalah reaksi dimana suatu zat direaksikan dengan sumber oksigen sehingga berikatan dengan oksigen tersebut (membentuk oksida).
- Reduksi adalah reaksi dimana suatu zat berupa oksida direaksikan dengan zat yang menarik oksigen sehingga oksida tersebut kehilangan oksigen.
Dengan kata lain:
- Oksidasi adalah pengikatan oksigen.
- Reduksi adalah pelepasan oksigen.
Oksidator adalah sumber oksigen yang mengoksidasi zat lain dan tereduksi.
Reduktor adalah penarik oksigen yang mereduksi zat lain dan teroksidasi.
Contoh oksidasi menurut konsep ini:
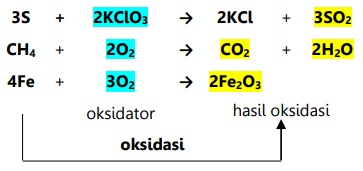
Contoh reduksi menurut konsep ini:
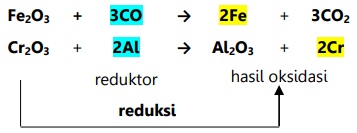
Konsep reaksi ini dapat dikatakan sempit karena tidak seluruh reaksi oksidasi melibatkan reduksi, dan tidak seluruh reaksi reduksi melibatkan oksidasi.
Adapun contoh reaksi yang melibatkan reduksi dan oksidasi menurut konsep ini:
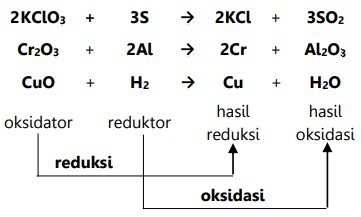
Redoks Berdasarkan Pelepasan dan Penerimaan Elektron

Menurut konsep ini:
- Oksidasi adalah semua proses reaksi kimia yang disertai pelepasan elektron.
- Reduksi adalah semua proses reaksi kimia yang disertai penerimaan elektron.
Dengan kata lain:
- Oksidasi adalah pelepasan elektron.
- Reduksi adalah penerimaan elektron.
Oksidator adalah penerima elektron dan tereduksi.
Reduktor adalah pelepas elektron dan teroksidasi.
Berdasarkan konsep ini, seluruh reaksi oksidasi/reduksi terjadi secara bersamaan karena tiap ada zat yang melepas elektron, ada pula zat yang menerima elektron. Oleh karena itu, tiap reaksi oksidasi atau reaksi reduksi menurut konsep ini adalah reaksi redoks.
Setengah reaksi redoks adalah reaksi reduksi atau reaksi oksidasi saja dalam suatu keseluruhan reaksi redoks.
Contoh reaksi redoks:
Reaksi redoks pembentukan magnesium klorida terjadi menurut reaksi:
Mg + Cl2 --> MgCl2
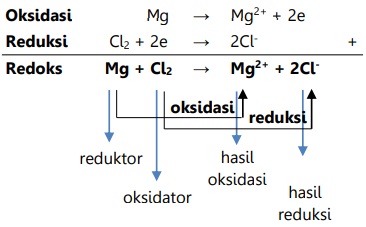
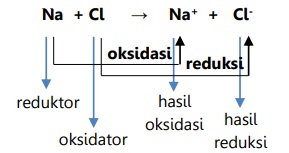
Redoks Berdasarkan Peningkatan dan Penurunan Bilangan Oksidasi

Menurut konsep ini:
- Oksidasi adalah pertambahan/kenaikan bilangan oksidasi.
- Reduksi adalah penurunan bilangan oksidasi.
Dengan kata lain:
- Oksidasi adalah pertambahan biloks.
- Reduksi adalah penurunan biloks.
Oksidator adalah zat yang mengalami penurunan bilangan oksidasi dan menaikkan bilangan oksidasi zat lain.
Reduktor adalah zat yang mengalami pertambahan bilangan oksidasi dan menurunkan bilangan oksidasi zat lain.
Contoh reaksi redoks:
Bagaimana aturan bilangan biloks akan kita pelajari pada modul berikutnya ya Sobat!
1.
Perhatikan reaksi berikut!
Na(s) --> Na+(s) + e-
Reaksi diatas merupakan reaksi ?
A. Oksidasi
B. Reduksi
C. Eliminasi
D. Subtitusi
E. adisi
JAWABAN BENAR
A.
Oksidasi
PEMBAHASAN
Na(s) --> Na+(s) + e-
Pada reaksi tersebut terjadi pelepasan elektron oleh Na, reaksi pelepasan elektron merupakan reaksi oksidasi.
2.
Apabila suatu unsur menerima elektron, maka ....
A. Bilangan oksidasinya akan turun
B. Bilangan oksidasinya akan naik
C. Reaktivitasnya akan meningkat
D. Unsur tersebut mengalami oksidasi
E. Menghasilkan bilangan oksidasi positif
JAWABAN BENAR
A.
Bilangan oksidasinya akan turun
PEMBAHASAN
Apabila unsur menerima elektron maka muatannya akan menjadi negatif sehingga bilangan oksidasinya kan menurun.
3.
Reaksi kimia yang ditandai berkurangnya senyawa yang mengandung oksigen disebut…
A. Oksidator
B. Oksidasi
C. Reduktor
D. Redoks
E. Reduksi
JAWABAN BENAR
E.
Reduksi
PEMBAHASAN
Berkurangnya oksigen pada senyawa merupakan reaksi reduksi.
4.
Jika suatu zat berperan sebagai oksidator dalam suatu reaksi, zat tersebut akan....
A. mengalami oksidasi
B. melepaskan elektron
C. mengalami penurunan bilangan oksidasi
D. menerima oksigen
E. melepaskan hidrogen
JAWABAN BENAR
C.
mengalami penurunan bilangan oksidasi
PEMBAHASAN
Oksidator atau pengoksidasi merupakan spesi kimia yang mengalami reduksi atau mengalami penurunan bilangan oksidasi.
5.
Berdasarkan konsep perkembangan reaksi redoks, reaksi reduksi adalah peristiwa....
A. penangkapan oksigen
B. pelepasan proton
C. pelepasan elektron
D. penerimaan proton
E. pengurangan bilangan oksidasi
JAWABAN BENAR
E.
pengurangan bilangan oksidasi
PEMBAHASAN
Reaksi reduksi dapat ditandai salah satunya dengan berkurangnya bilangan oksidasi.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

