Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Sifat Koligatif Larutan
MATERI
Larutan Elektrolit

Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Dalam larutan elektrolit molekul-molekulnya terurai (terdisosiasi) menjadi partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif-ion negatif). Ion positif yang dihasilkan dinamakan kation dan ion negatif yang dihasilkan dinamakan anion.
Larutan elektrolit dapat menghantarkan listrik karena:
- Pada senyawa ionik, larutan terion menjadi ion-ion bermuatan listrik yang bergerak bebas menghantarkan listrik.
Contoh: NaCl --> Na+ + Cl-
Dapat menghantarkan listrik dalam bentuk larutan dan lelehan. - Pada senyawa kovalen polar, larutan terion akibat gaya tarik antar molekul yang memutuskan ikatan atom molekul.
Contoh: CH3COOH --> CH3COO- + H+
Dapat menghantarkan listrik dalam bentuk larutan. Lelehannya tidak dapat menghantarkan listrik.
Larutan elektrolit dapat dikelompokkan menjadi larutan elektrolit kuat dan larutan elektrolit lemah.
Larutan Elektrolit Kuat
Yaitu larutan yang semua molekulnya terurai menjadi ion-ion (terionisasi sempurna). Oleh karena banyaknya ion-ion penghantar listrik yang terbentuk, maka daya hantarnya juga kuat. Umumnya larutan elektrolit kuat adalah larutan garam.
Ciri-ciri dari elektrolit kuat yaitu sebagai berikut :
- Terionisasi sempurna
- Mempunyai daya hantar listrik yang baik
- Derajat ionisasi

- Uji lampu dan gelembung:
Lampu nyala terang
Menghasilkan banyak gelembung - Biasanya berupa asam kuat, basa kuat dan garam yang kation dan anionnya dari asam dan basa kuat
Contohnya:
- Garam (NaCl, KCl, CuSO4 dan KNO3)
- Asam kuat (HCl, HI, HBr, H2SO4 dan HNO3)
- Basa kuat (NaOH, KOH, Mg(OH)2, dan Ca(OH)2)
Contoh reaksi penguraian elektrolit kuat:
NaCl(aq) ---> Na+(aq) + Cl–(aq)
H2SO4(aq) ---> 2H+(aq) + SO42-(aq)
Larutan Elektrolit Lemah
Yaitu larutan yang tidak semua molekulnya terionisasi (ionisasi tidak sempurna), sehingga hanya sedikit ion-ion yang dapat menghantarkan listrik.
Ciri-ciri dari elektrolit lemah yaitu sebagai berikut :
- Terionisasi sebagian
- Mempunyai daya hantar listrik yang kurang baik atau lemah
- Derajat ionisasi
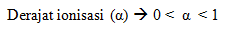
- Uji lampu dan gelembung:
Lampu nyala redup
Menghasilkan sedikit gelembung - Biasanya berupa asam lemah dan basa lemah
Contohnya:
- Asam lemah (HCN, H3PO4, CH3COOH dan H2CO3),
- Basa lemah (NH4OH, Al(OH)3 dan Fe(OH)3)
Contoh reaksi penguraian elektrolit lemah:
CH3COOH(aq) --> CH3COO-(aq) + H+(aq)
Larutan Elektrolit dalam Kehidupan Sehari-hari

Dalam kehidupan sehari-hari larutan ini dapat dimanfaatkan dalam beberapa hal seperti :
Akumulator (aki) berfungsi menyimpan energi (listrik) dalam bentuk energi kimia. Seperti baterai dan kapasitor. Larutan elektrolit yang tergantung pada aki berupa asam sulfat (H2SO4).

Cairan tubuh, cairan tubuh manusia mengandung larutan elektrolit dimana berfungsi sebagai penghantar daya listrik untuk kerja impuls saraf.

Garam dapur, bumbu yang sangat penting untuk memasak. Secara kimia garam tersusun dari unsur natrium dan klorin yang bergabung membentuk senyawa natrium klorida (NaCl) yang merupakan elektrolit kuat.

Jeruk nipis atau bisa juga disebut sebagai asam sitrat dapat digunakan sebagai bahan pengawet alami, penambah rasa masa, dan penghambat proses pembentukan batu ginjal.

Larutan Nonelektrolit

Larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Larutan-larutan non-elektrolit terdiri atas zat-zat yang terlarut dalam air namun tidak terurai menjadi ion (tidak terionisasi). Dalam larutan, zat non-elektrolit tetap seperti molekul yang tidak bermuatan listrik. Itulah mengapa larutan ini tidak dapat menghantarkan arus listrik.
Contoh larutan non-elektrolit adalah Larutan urea, larutan sukrosa, larutan glukosa, dan larutan alkohol.
Berikut ciri-ciri larutan non-elektrolit:
- Tidak dapat Terionisasi
- Tidak dapat menghantarkan listrik
- Tetapan/derajat ionisasi/alfa = 0
- Uji lampu dan gelembung:
Lampu mati
Tidak menghasilkan gelembung - Biasanya berupa senyawa yang berasal dari kelompok asam karboksilat dan senyawa yang tersusun dari unsur C, H atau C, H, O kecuali senyawa CH3COOH dan HCOOH
Contohnya:
- Urea = CO(NH2)2
- Glukosa = C6H12O6
- Sukrosa = C12H22O11
Contoh reaksi larutan non-elektrolit:
C6H12O6(s) --> C6H12O6(aq)
CO(NH2)2(s) --> CO(NH2)2(aq)
Larutan Elektrolit dalam Kehidupan Sehari-hari

Dalam kehidupan sehari-hari larutan ini dapat dimanfaatkan dalam beberapa hal seperti :
Gula adalah suatu karbohidrat sederhana yang menjadi sumber energi dan komoditi perdagangan utama. Gula sederhana, seperti glukosa, (yang diproduksi dari sukrosa dengan enzim atau hidrolisis asam), menyimpan energi, yang akan digunakan oleh sel.

Urea adalah suatu senyawa organik, yang terdiri dari unsur karbon, hidrogen, oksigen dan nitrogen dengan rumus CON2H4 atau (NH2)2CO. Senyawa ini pada umumnya digunakan sebagai pupuk di bidang pertanian.

Alkohol dalam kehidupan sehari-hari digunakan sebagai pelarut, obat-obatan dan bahan bakar. Alkohol 70% biasa digunakan untuk desinfektan, larutan iodium dalam alkohol (iodium tinture) digunakan sebagai obat luka.

Sabun mengandung gliserin. Gliserin adalah tidak ada dalam sabun komersial keras. Komersial produsen sabun gliserin ekstrak, oleh-produk dalam pembuatan sabun. Gliserin hadir dalam nabati dan lemak hewani.

1.
Jawablah soal berikut ini!
Larutan elektrolit kuat dapat membuat lampu pada alat uji elektrolit menyala karena….
A. terurai sebagian menjadi ion-ion
B. terjadi aliran ion-ion
C. terbentuk banyak ion-ion
D. terjadi pengendapan
E. terurai menjadi gas
JAWABAN BENAR
B.
terjadi aliran ion-ion
PEMBAHASAN
Adanya aliran listrik terjadi karena adanya aliran elektron akibat beda potensial. Aliran elektron terjadi karena adanya ion-ion dalam larutan.
2.
Jawablah soal berikut ini!
Di antara zat berikut, ketika di dalam air dapat membentuk larutan elektrolit kuat adalah....
A. gula pasir
B. alkohol
C. formalin
D. cuka
E. garam dapur
JAWABAN BENAR
E.
garam dapur
PEMBAHASAN
Larutan garam dapur atau NaCl merupakan larutan elektrolit kuat karena dapat terionisasi menjadi ion-ion penyusunnya.
3.
Jawablah soal berikut ini!
Di antara zat berikut, ketika di dalam air dapat membentuk larutan elektrolit lemah adalah.....
A. gula pasir
B. alkohol
C. formalin
D. cuka
E. garam dapur
JAWABAN BENAR
D.
cuka
PEMBAHASAN
Larutan cuka atau CH3COOH merupakan larutan elektrolit lemah karena dapat terionisasi menjadi ion-ion penyusunnya namun tidak sempurna.
4.
Jawablah soal berikut ini!
Yang tidak termasuk ciri larutan nonelektrolit adalah...
A. Tidak dapat Terionisasi
B. Tidak dapat menghantarkan listrik
C. Tetapan/derajat ionisasi = 0
D. Jika diuji dengan alat uji elektrolit, larutan ini tidak menghasilkan reaksi apapun.
E. Menghantarkan listrik
JAWABAN BENAR
E.
Menghantarkan listrik
PEMBAHASAN
Larutan yang dapat menghantarkan listrik adalah larutan elektrolit. Larutan nonelektrolit tidak dapat menghantarkan listrik.
5.
Jawablah soal berikut ini!
Di antara senyawa ion berikut, yang tidak dapat menghantarkan arus listrik di dalam air adalah....
A. C2H5OH
B. MgCl2
C. KCl
D. Sr(NO3)2
E. CaCl2
JAWABAN BENAR
A.
C2H5OH
PEMBAHASAN
C2H5OH tidak dapat menghantarkan arus listrik karena C2H5OH merupakan larutan nonelektrolit.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

