Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Sifat Koligatif Larutan
MATERI
Pengertian Sifat Koligatif

Dalam larutan sendiri terdapat 2 komponen utama pembentuk larutan, yaitu zat terlarut dan zat pelarut (biasanya air). Hubungannya dengan sifat koligatif adalah banyaknya jumlah mol zat terlarut dalam larutan tersebut.
Sifat koligatif bergantung pada jumlah zat yang terlarut pada larutan. Sifat koligatif terdiri atas penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.

Menurut hukum sifat koligatif, selisih tekanan uap, titik beku, dan titik didih suatu larutan dengan tekanan uap, titik beku, dan titik didih pelarut murninya, berbanding langsung dengan konsentrasi zat terlarut. Larutan yang bisa memenuhi hukum sifat koligatif ini disebut larutan ideal. Kebanyakan larutan mendekati ideal hanya jika sangat encer.
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergantung pada jumlah zat terlarut yang larut pada suatu larutan.
Sifat Koligatif Larutan Non Elektrolit

Sifat koligatif larutan non elektrolit berbeda dengan Sifat koligatif larutan elektrolit, disebabkan larutan non elektrolit tidak dapat mengurai menjadi ion-ionnya. Maka Sifat koligatif larutan non elektrolit dapat dihitung dengan menghitung tekanan uap, titik didih, titik beku, dan tekanan osmosis.
Macam-macam sifat koligatif larutan non elektrolit adalah sebagai berikut:
Penurunan tekanan uap
Semakin banyak zat terlarut maka menjadikan tekanan uap larutan lebih kecil dari tekanan uap larutan murni atau dengan kata lain penambahan zat terlarut akan menghambat proses penguapan (tekanan uap turun).
Penurunan tekanan uap tersebut dirumuskan dengan:
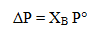

Kenaikan titik didih
Semakin banyak zat terlarut maka menjadikan titik didih larutan lebih besar dari titik didih larutan murni atau dengan kata lain penambahan zat terlarut akan menghambat proses mendidih (titik didih naik).
Dimisalkan titik didih air adalah 100oC, maka ketika ditambahkan zat terlarut titik didihnya akan lebih besar dari 100oC (naik).
Kenaikan titik didih dirumuskan dengan:
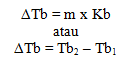

Penurunan titik beku
Semakin banyak zat terlarut maka menjadikan titik beku larutan lebih rendah dari titik beku larutan murni atau dengan kata lain penambahan zat terlarut akan menghambat proses pembekuan (titik beku turun).
Dimisalkan titik beku air adalah 0oC, maka ketika ditambahkan zat terlarut titik bekunya akan lebih rendah dari 0oC (turun).
Penurunan titik beku dirumuskan dengan:
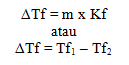

Tekanan osmotik
Osmosis merupakan fenomena ketika terdapat 2 larutan yang berbeda konsentrasi dipisahkan oleh membran semipermeabel yang kemudian terjadi perpindahan pelarut dari larutan yang lebih encer menuju larutan yang lebih pekat.
Tekanan osmotik pada larutan dirumuskan dengan:
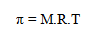

Sifat Koligatif Larutan Elektrolit

Berbeda dengan sifat koligatif larutan nonelektrolit, larutan elektrolit memiliki sifat koligatif yang nilainya lebih besar dari hasil perhitungan dengan persamaan untuk sifat koligatif larutan nonelektrolit yang sebelumnya. Hal tersebut dikarenakan larutan elektrolit dapat terurai menjadi ion-ionnya sehingga mempengaruhi nilai dari sifat koligatif.
Perbandingan antara sifat koligatif larutan elektrolit yang terlihat dan hasil perhitungan dengan persamaan untuk sifat koligatif larutan nonelektrolit, menurut Van’t Hoff besarnya selalu tetap dan diberi simbol i (i = tetapan atau faktor Van’t Hoff ). Dengan demikian dapat dituliskan:
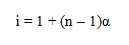

Macam-macam sifat koligatif larutan elektrolit adalah sebagai berikut:
Penurunan tekanan uap jenuh
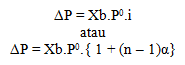

Kenaikan titik didih
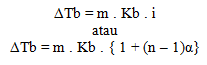

Penurunan titik beku
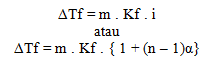

Tekanan osmotik
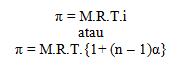

Hubungan Sifat Koligatif dengan Diagram Fasa

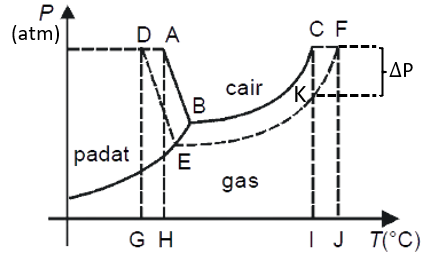
Dari diagram diatas, Sobat bisa melihat hubungan dari tekanan dengan titik didih dan titik beku suatu larutan.
Diagram diatas menggambarkan penambahan zat terlarut ke dalam pelarut murni, misalnya air, sehingga terjadi penurunan tekanan uap.
Akibat adanya penurunan tekanan uap sebesar delta P, kurva fase A-B-C bergeser menjadi D-E-F. Hal ini menyebabkan terjadi penurunan titik beku (dari H ke G) dan kenaikan titik didih (dari I ke J).
1.
Kerjakan soal berikut dengan benar!
Sebanyak 12,2 gram asam benzoat (Mr = 122) dilarutkan dalam 244 gram etanol. Tentukan kenaikan titik didih etanol jika tetapan kenaikan titik didih etanol adalah 1,22oC/m
A. 0,5 oC
B. 0,6oC
C. 0,7oC
D. 0,8oC
E. 0,9oC
JAWABAN BENAR
A.
0,5 oC
PEMBAHASAN
Data:
a = 12,2 gram
Mr = 122
p = 244 gram
Kb = 1,22
Kenaikan titik didih =….
Dari rumus kenaikan titik didih larutan
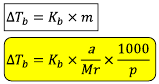
Sehingga,
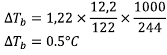
2.
Kerjakan soal berikut dengan tepat!
Asam benzoat dengan Mr = 122 sebanyak 15,25 g dilarutkan ke dalam 122 gram zat X menyebabkan kenaikan titik didih sebesar 1,25oC. Besarnya tetapan kenaikan titik didih zat X tersebut adalah….
A. 2,24
B. 1,83
C. 1,55
D. 1,22
E. 1,71
JAWABAN BENAR
D.
1,22
PEMBAHASAN
Data:
a = 15,25 gram
Mr = 122
kenaikan titik didih = 1,25°C
p = 122
Kb =….
Masih tentang kenaikan titik didih:
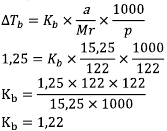
3.
Jawablah soal berikut dengan benar!
Tekanan osmotik dari 500 ml larutan yang mengandung 6,84 gram gula (Mr 342) pada suhu 27oC dengan R = 0,082 L atm/mol.K adalah (dalam atm) .....
A. 4,92
B. 2,46
C. 98,4
D. 0,984
E. 9,84
JAWABAN BENAR
D.
0,984
PEMBAHASAN
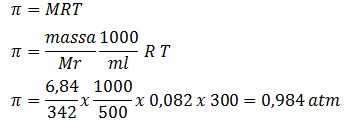
4.
Kerjakan soal berikut!
Diantara sifat berikut yang tidak termasuk sifat koligatif larutan adalah....
A. penurunan titik beku
B. kenaikkan titik didih
C. penurunan tekanan osmotik
D. penurunan tekanan uap jenuh
E. tekanan osmotik
JAWABAN BENAR
C.
penurunan tekanan osmotik
PEMBAHASAN
Yang bukan termasuk sifat koligatif larutan adalah penurunan tekanan osmotik.
5.
Kerjakan soal berikut dengan benar!
22,2 gram CaCl2 (Mr = 111) dilarutkan dalam 250 gram air (Kb = 0,92)(Kf = 1,86), maka titik beku larutan tersebut adalah.....
A. -4,464oC
B. 4,464oC
C. 0,372oC
D. -0,372oC
E. -0,21oC
JAWABAN BENAR
A.
-4,464oC
PEMBAHASAN
CaCl2 merupakan larutan elektrolit dengan ionisasi:
CaCl2 --> Ca2+ + 2Cl-
Maka nilai n = 3
Tidak terdapat nilai derajat ionisasi maka nilai i = n = 3
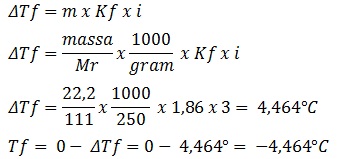
6.
Jawablah soal berikut dengan tepat!
Sebanyak 12 gram MgSO4 (Mr = 120) dilarutkan dalam 500 gram air. Apabila Kb air = 0,52oC m-1, penurunan titik didih larutan MgSO4 adalah … oC.
A. 0,104
B. 0,208
C. 0,312
D. 0,416
E. 0,520
JAWABAN BENAR
A.
0,104
PEMBAHASAN
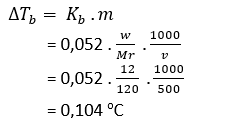
7.
Kerjakan soal berikut dengan benar!
Sebanyak 30 gram elektrolit biner (Mr = 95 g/mol) dilarutkan dalam air sampai volume 1 L pada suhu 27oC dan memiliki tekanan osmotik 10 atm. Derajat ionisasi elektrolit biner tersebut adalah….
A. 0,287
B. 0,284
C. 0,282
D. 0,280
E. 0,278
JAWABAN BENAR
A.
0,287
PEMBAHASAN
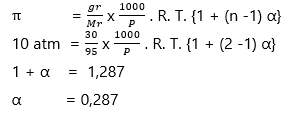

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

