Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Sifat Koligatif Larutan
MATERI
Persen Berat atau Persen Massa

Persen Berat atau Persen Massa
Bila menyatakan persen berat, persentase yang diberikan itu merujuk ke zat terlarut. Pernyataan “5,00 g NaCl per 100,0 g larutan berair” mempunyai pengertian : Larutan yang dibuat dari 5,00 g NaCl dan melarutkannya dalam 95,0 g H2O, yaitu massa air yang cukup untuk menghasilkan 100,0 gr larutan. Larutan ini dapat dikatakan larutan “5% NaCl berdasar massa".
Satuan konsentrasi ini, yang kuantitas terlarut dan larutannya diukur berdasar massa, juga dinamakan persen massa/massa atau %(massa/massa).
Persen massa dapat didefinisikan dengan persamaan :

Contoh soal:
Hitunglah berapa persen massa pada 20 gram magnesium hidroksida yang dilarutkan dalam 140 gram air!
Penyelesaian:

Sehingga persen massa dari 20 gram magnesium hidroksida dalam 140 gram air sebesar 12,5%.
Molaritas

Molaritas (M)
Molaritas suatu larutan ialah banyaknya mol zat terlarut per liter larutan.
Misalnya beberapa gram garam dapur dilarutkan dalam 1 liter air, maka satuan konsentrasi garam dapur yang terlarut tersebut dinyatakan sebagai Molaritas, dan disimbolkan dengan M (em besar).
Rumusnya:

Contoh soal:
Hitunglah molaritas dari 29 gram magnesium hidroksida (Mr 58) yang dilarutkan dalam 500 ml air!
Penyelesaian:

Sehingga molaritas dari 29 gram magnesium hidroksida dalam 500 ml air sebesar 1 M.
Molalitas

Molalitas (m)
Molalitas suatu larutan ialah banyaknya mol zat terlarut per kilogram larutan.
Seperti dimisalkan beberapa gram gula dilarutkan dalam 1 kilogram air, maka satuan konsentrasi gula yang terlarut tersebut dapat dinyatakan sebagai Molalitas, dan disimbolkan dengan m (em kecil).
Rumusnya:

Contoh soal:
Hitunglah molalitas dari 18 gram gula (Mr 180) yang dilarutkan dalam 250 gram air!
Penyelesaian:

Sehingga molalitas dari 18 gram gula dalam 250 gram air sebesar 0,4 m.
Fraksi Mol

Fraksi mol
Fraksi mol merupakan satuan konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol.
Fraksi mol adalah suatu besaran konsentrasi larutan yang menyatakan perbandingan antara jumlah mol suatu komponen dengan jumlah total seluruh komponen dalam satu larutan. Fraksi mol tidak mempunyai satuan dan dinotasikan dengan x dan Fraksi mol total selalu bernilai satu. (Total fraksi mol = 1)
Rumusnya:

Contoh soal:
Berapakah fraksi mol dari 12 gram urea (Mr 60) yang dilarutkan dalam 72 gram air (Mr 18) ?
Penyelesaian:

Sehingga fraksi mol dari 12 gram urea dalam 72 ml air sebesar 0,047.
Setelah tadi kita belajar tentang Satuan Konsentrasi, habis ini kita coba kerjain soal-soal latihan nih Sobat. Yuk kita coba kerjain!
1.
Jawablah soal berikut dengan tepat!
Kemolalan larutan NaCL 10% massa dalam air adalah... (Mr NaCl = 58,51)
A. 1,50 m
B. 1,60 m
C. 1,70 m
D. 1,80 m
E. 1,90 m
JAWABAN BENAR
E.
1,90 m
PEMBAHASAN
NaCl 10%, berarti persentase air sebesar 90%
untuk NaCl seberat 10 gram maka airnya sebanyak 90 gram
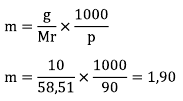
2.
Kerjakan soal berikut dengan tepat!
Sebuah larutan terdiri dari 3 mol zat A, 3 mol zat B, dan 4 mol zat C. Hitung fraksi mol dari zat A dan zat C dari larutan tersebut ?
A. 0,3 dan 0,2
B. 0,3 dan 0,3
C. 0,3 dan 0,4
D. 0,4 dan 0,3
E. 0,4 dan 0,4
JAWABAN BENAR
C.
0,3 dan 0,4
PEMBAHASAN
Mol dari ketiga zat:
- nA = 3
- nB = 3
- nC = 4
Fraksi mol dari zat A dan zat C:
- xA = nA/(nA + nB + nC)
xA = 3/(3 + 3 + 4)
xA = 0,3 - xC = nC/(nA + nB + nC)
xC = 4/(3 + 3 + 4)
xC = 0,4
3.
Jawablah soal berikut dengan tepat!
Hitung kemolalan larutan HCl 15%, (Mr HCl = 36,46)
A. 3,21 m
B. 3,69 m
C. 4,02 m
D. 4,84 m
E. 5,10 m
JAWABAN BENAR
D.
4,84 m
PEMBAHASAN
15% HCl artinya terdapat 15 gram HCl dalam 100 gram larutan = 15 gram HCl terlarut + 85 gram air pelarut.
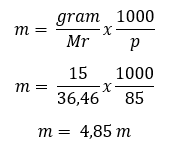
4.
Jawablah soal berikut dengan benar!
Berapa molaritas 100 mL larutan yang mengandung 4 gram urea (CH4ON2) ? (Mr urea = 60)
A. 0,333 M
B. 0,667 M
C. 1,000 M
D. 1,250 M
E. 1,667 M
JAWABAN BENAR
B.
0,667 M
PEMBAHASAN
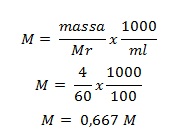
5.
Jawablah soal berikut dengan tepat!
Berapa fraksi mol zat pelarut dalam larutan 15% HCl ? (Ar H = 1, Cl = 35,46, O = 16)
A. 0,08
B. 0,42
C. 0,50
D. 0,85
E. 0,92
JAWABAN BENAR
E.
0,92
PEMBAHASAN

6.
Kerjakan soal berikut dengan tepat!
Suatu larutan dikatakan mempunyai konsentrasi 1 molal apabila….
A. dalam 1.000 gram pelarut terdapat 1 gram zat terlarut
B. dalam 1.000 gram pelarut terdapat 100 gram zat terlarut
C. dalam 1.000 gram pelarut terdapat 1 mol zat terlarut
D. dalam 1.000 gram larutan terdapat 1 mol zat terlarut
E. dalam 1.000 mL pelarut terdapat 1 mol zat terlarut
JAWABAN BENAR
D.
dalam 1.000 gram larutan terdapat 1 mol zat terlarut
PEMBAHASAN
Molalitas suatu larutan ialah banyaknya mol zat terlarut per kilogram larutan atau banyaknya mol zat terlarut per 1000 gram larutan.
7.
Kerjakan soal berikut dengan benar!
Larutan urea dibuat dengan melarutkan 3 gram urea ke dalam 100 mL air. Berapakah kemolalan larutan dan fraksi mol urea dalam larutan tersebut?
A. 9,8 x 10-3
B. 9,0 x 10-3
C. 8,9 x 10-3
D. 7,8 x 10-3
E. 6,8 x 10-3
JAWABAN BENAR
C.
8,9 x 10-3
PEMBAHASAN


Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

