Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Kimia
Struktur Atom dan Sistem Periodik Unsur
MATERI
Konfigurasi elektron

Konfigurasi elektron adalah susunan elektron dalam suatu atom mulai dari orbital berenergi rendah hingga ke orbital berenergi tinggi.
Menurut Niels Bohr bahwa elektron yang mengelilingi inti akan membentuk lintasan-lintasan yang dikenal dengan nama kulit atom.
Kulit yang terdekat dengan inti disebut kulit K dan merupakan tingkat energi yang paling rendah. Selanjutnya kulit L, M, N dan seterusnya.
Jumlah elektron maksimum yang dapat mengisi setiap kulit adalah 2n2. Dimana n = nomor kulit
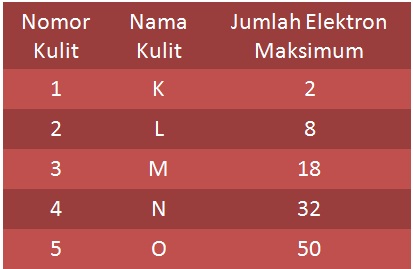
Di dalam kulit tersebut juga dapat dibagi lagi menjadi subkulit dimana dapat menentukan juga jumlah elektron yang terdapat pada orbital atau lintasannya. Aturan penulisan konfigurasinya dituliskan dalam beberapa aturan sebagai berikut:
Aturan Aufbau
”Pengisian elektron dalam orbital dimulai dari orbital dengan tingkat energi paling rendah. Setelah penuh, pengisian berlanjut ke orbital yang tingkat energinya satu tingkat lebih tinggi. Demikian seterusnya hingga semua elektron menempati orbital”. Skema energi pada aturan Aufbau digambarkan sebagai berikut:
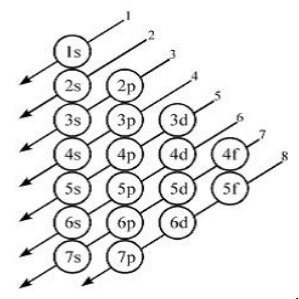
Aturan Hund
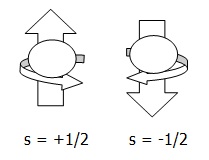
”Elektron-elektron yang berada di suatu orbital akan menempati orbital yang kosong dengan arah rotasi sejajar. Setelah itu, elektron-elektron lainnya menempati orbital tersebut dengan arah rotasi yang berlawanan”. Seperti digambarkan pada gambar berikut ini:
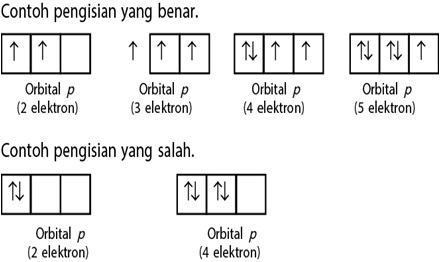
Larangan Pauli
”Tidak ada dua buah elektron dalam orbital yang sama memiliki keempat bilangan kuantum yang sama”. Bilangan kuantum spin harus berlawanan dan Jumlah elektron maksimum adalah 2 x jumlah orbital dalam subkulit. Seperti pada gambar berikut:
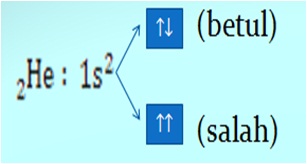
Diagram Orbital dibuat dengan tahapan berikut.
- Menulis konfigurasi elektron berdasarkan aturan Aufbau
- Membuat panah pada subkulit sesuai dengan banyaknya elektron pada orbital yang dimiliki.
Berikut merupakan contoh pengisian elektron pada diagram orbital untuk atom karbon.
6C : 1s2 2s2 2p2
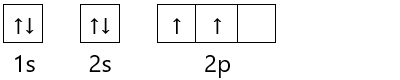
Selain itu, konfigurasi elektron juga dapat menentukan jumlah pada elektron valensi. Elektron valensi adalah jumlah elektron pada subkulit dengan harga n terbesar yang digunakan untuk pembentukan ikatan kimia.
Contoh:
Konfigurasi elektron dari 11Na adalah 1s2 2s2 2p6 3s1, n atau kulit terbesarnya adalah 3 dan pada kulit tersebut hanya terdapat 1 buah elektron, sehingga elektron valensinya sejumlah 1.
Bilangan Kuantum

Bilangan kuantum adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang diwakili oleh suatu nilai dalam sistem dinamis. Bilangan ini menggambarkan sifat elektron dalam orbital.
Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
Terdapat 4 jenis bilangan kuantum diantaranya adalah bilangan kuantum utama (n), bilangan kuantum azimut (l), bilangan kuantum magnetik (m), dan bilangan kuantum spin (s).
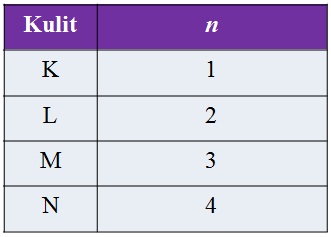
Bilangan Kuantum Utama (n)
Menyatakan posisi elektron dalam kulit atom, menjelaskan jarak rata-rata awan elektron dari inti atom, serta menyatakan tingkat energi elektron dalam suatu atom.
Semakin besar nilai n, tingkat energi atom semakin tinggi.
Bilangan kuantum utama mempunyai harga mulai dari 1, 2, 3, 4, dan seterusnya.
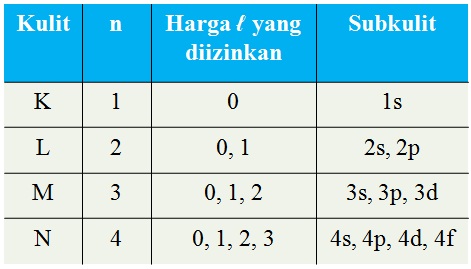
Bilangan Kuantum Azimut (l)
Menyatakan subkulit atau orbital.
Harga l = 0, 1, 2, ...,(n-1)
- harga l = 0 --> subkulit s
- harga l = 1 --> subkulit p
- harga l = 2 --> subkulit d
- harga l = 3 --> subkulit f
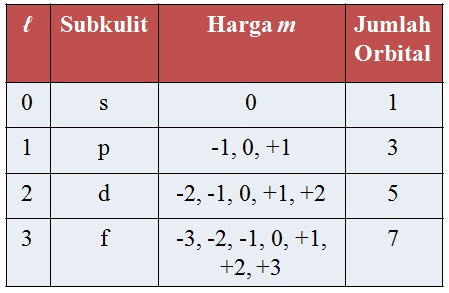
Bilangan Kuantum Magnetik (m)
Menentukan orientasi orbital dalam ruang di sekitar inti atom.
Harga m = +l, 0, -l
Bilangan Kuantum Spin (s)
Menyatakan arah putar elektron terhadap sumbunya (berotasi) sewaktu elektron berputar mengelilingi inti atom.
Sistem Periodik Unsur dan Kedudukan Unsur

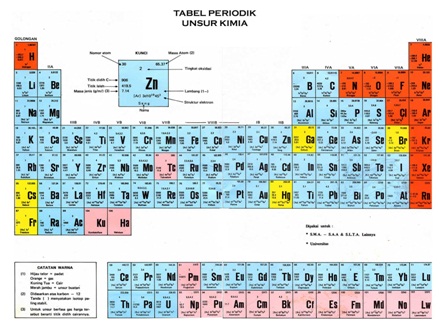
Sistem periodik unsur adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan kenaikan nomor atom, konfigurasi elektron, dan keberulangan sifat kimia. Lajur horizontal disebut periode, disusun menurut kenaikan nomor atom. Sedangkan lajur vertikal disebut golongan, disusun menurut kemiripan sifat.
Golongan
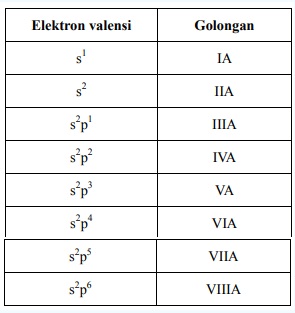
Berada pada lajur vertikal, golongan menyatakan elektron valensi suatu unsur. Ditulis dengan angka Romawi.
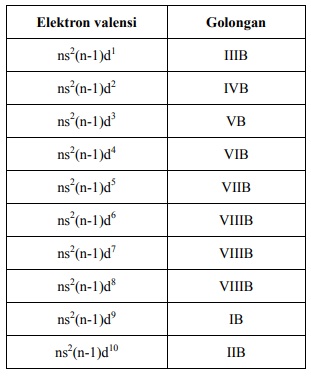
Terdiri atas 8 golongan utama (IA sampai VIIIA), 8 golongan transisi (IB sampai VIIIB), dan golongan transisi dalam (Laktanida dan Aktinida).
Periode
Berada pada lajur horizontal, periode menyatakan jumlah kulit atom unsur. Ditulis dengan angka latin. Terdiri atas 7 periode.
Konfigurasi elektron sangat erat hubungannya dengan sistem periodik unsur. Hubungan konfigurasi elektron dengan kedudukan unsur dalam sistem periodik ditunjukkan oleh elektron valensi dan bilangan kuantum utama (n) atau kulit terbesar.
Kedudukan Unsur dalam Golongan
Kedudukan unsur dalam golongan ditentukan oleh elektron valensinya. Jika jumlah elektron luar yang mengisi orbital dalam subkulit sama, maka atom unsur tersebut pasti terletak pada golongan yang sama (selain yang berbentuk ion).
a. Golongan utama
b. Golongan Transisi
Letak unsur dalam periode
Letak unsur dalam periode dapat ditunjukkan dengan nilai n (bilangan kuantum utama) yang terbesar.
1.
Kerjakan soal berikut ini dengan tepat!
Konfigurasi elektron dari 11Na adalah...
A. 1s2 2s2 2p5 2s2
B. 1s2 2s2 2p7
C. 1s2 2s2 2p6 3s1
D. 2s2 2s2 2p5 2s1
E. 1s2 2s2 2p6 3d1
JAWABAN BENAR
C.
1s2 2s2 2p6 3s1
PEMBAHASAN
11Na nomor atomnya 11 --> 11 elektron, maka konfigurasinya adalah :
1s2 2s2 2p6 3s1
2.
Kerjakan soal berikut ini dengan tepat!
11Na terletak pada periode dan golongan berapa ?
A. periode 2, golongan I A
B. periode 1, golongan III A
C. periode 3, golongan III A
D. periode 2, golongan III A
E. periode 3, golongan I A
JAWABAN BENAR
E.
periode 3, golongan I A
PEMBAHASAN
11Na nomor atomnya 11 --> 11 elektron, maka konfigurasinya adalah :
1s2 2s2 2p6 3s1
kulit terluarnya adalah 3 = periode 3
jumlah elektron valensi adalah 1 = golongan I A
3.
Kerjakan soal berikut ini dengan tepat!
Letak unsur dan konfigurasi elektron yang tepat untuk unsur 19X adalah.....
A. Periode 4, golongan IA, [Ar] 4s1
B. Periode 1, golongan IB, [Ar] 4d1
C. Periode 1, golongan IIA, [Ar] 4s2
D. Periode 2, golongan IIB, [Ar] 4d2
E. Periode 3, golongan IVA, [Ar] 4s2 3d2
JAWABAN BENAR
A.
Periode 4, golongan IA, [Ar] 4s1
PEMBAHASAN
Menentukan letak unsur
19X : 1s2 2s2 2p6 3s2 3p6 4s1
atau [Ar] 4s1
n = 4 --> periode 4
elektron valensi = 1 --> golongan IA
4.
Kerjakan soal berikut ini dengan tepat!
Harga keempat bilangan kuantum elektron terakhir dari atom 16S adalah....
A. n = 2, l = 0, m = 0, s = -1/2
B. n = 3, l = 1, m = -1, s = -1/2
C. n = 3, l = 1, m = 0, s = -1/2
D. n = 3, l = 1, m = 0, s = +1/2
E. n = 3, l = 1, m = +1, s = +1/2
JAWABAN BENAR
B.
n = 3, l = 1, m = -1, s = -1/2
PEMBAHASAN
Menentukan harga bilangan kuantum
16S : 1s2 2s2 2p6 3s2 3p4
Elektron terakhir berada pada orbital 3s 3p
Untuk orbital 3p yang terisi 4 elektron:
1. n = 3, l = 1, m = -1, s = +1/2
2. n = 3, l = 1, m = 0, s = +1/2
3. n = 3, l = 1, m = +1, s = +1/2
4. n = 3, l = 1, m = -1, s = -1/2
5.
Kerjakan soal berikut ini dengan tepat!
Unsur 17T dalam sistem periodik unsur terletak pada golongan dan periode berturut-turut....
A. IVA, 3
B. VA, 2
C. VIIA, 3
D. VA, 3
E. IVB, 2
JAWABAN BENAR
C.
VIIA, 3
PEMBAHASAN
menentukan letak unsur
17T : 1s2 2s2 2p6 3s2 3p5
Menurut atom Bohr, unsur T memiliki 3 kulit dan 7 elektron valensi maka T terletak pada periode 3 golongan VIIA. Hal ini jelas terlihat dari konfigurasi elektronnya.
6.
Kerjakan soal berikut ini dengan tepat!
Suatu elektron terakhir memiliki bilangan kuantum berturut-turut n = 4, l = 2, m = +1, s = -1/2
Jumlah elektron yang berpasangan dalam atom tersebut adalah …
A. 23
B. 24
C. 26
D. 28
E. 30
JAWABAN BENAR
A.
23
PEMBAHASAN
Kulit (n) = 4
Orbital (l) = 2 = d
m = +1
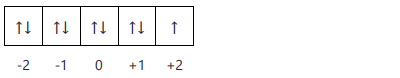
Subkulit elektron valensi: 4d9
Konfigurasi elektron = [Kr] 5s2 4d9
Jadi, terdapat 23 pasangan elektron
7.
Kerjakan soal berikut ini dengan tepat!
Suatu unsur golongan utama memiliki 6 elektron valensi pada kulit ke-4. Nomor atom unsur tersebut adalah …
A. 30
B. 32
C. 34
D. 37
E. 39
JAWABAN BENAR
C.
34
PEMBAHASAN
Orbital golongan utama (A) = ns np
Kulit ke-4 memiliki 6 elektron valensi = 4s2 4p4
Konfigurasi elektron = [Ar] 4s2 3d10 4p4
Jadi, nomor atom unsur tersebut adalah 34.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


