Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
IPA
Reaksi-Reaksi Kimia dan Dinamikanya
Daftar Materi
MATERI
Asam


Halo Sobat Pintar! Pada submodul ini, kita akan mempelajari tentang sifat asam. Apakah Sobat tahu apa itu asam? Asam adalah salah satu sifat kimia yang sangat penting untuk dipahami. Mari kita mulai!
Apa Itu Asam?
Asam adalah zat kimia yang dapat memberikan ion hidrogen (H+) ketika larut dalam air. Jadi, jika suatu zat dapat memberikan ion hidrogen dalam larutan, maka zat tersebut adalah asam. Asam biasanya memiliki rasa masam dan dapat merubah warna indikator menjadi merah.
Contoh-contoh Asam
Sobat Pintar mungkin sudah pernah mendengar tentang beberapa asam yang sering digunakan atau dijumpai dalam kehidupan sehari-hari. Berikut adalah beberapa contoh asam:
- Asam Klorida (HCl): Asam klorida adalah salah satu asam yang sangat kuat dan berbahaya. Ini sering digunakan dalam laboratorium kimia dan dalam industri untuk membersihkan logam.
- Asam Nitrat (HNO3): Asam nitrat juga merupakan asam kuat dan digunakan dalam produksi pupuk, bahan peledak, dan banyak aplikasi industri lainnya.
- Asam Sulfat (H2SO4): Asam sulfat adalah asam kuat lainnya yang memiliki banyak penggunaan, termasuk dalam industri otomotif, pembuatan baterai, dan banyak proses kimia lainnya.
Bahaya Asam
Sebagian besar asam kuat, seperti asam klorida, asam nitrat, dan asam sulfat, sangat berbahaya jika tidak ditangani dengan hati-hati. Mereka dapat menyebabkan kerusakan serius pada kulit, mata, dan bahkan dapat merusak pakaian. Oleh karena itu, selalu ingat untuk mengikuti petunjuk keamanan dan prosedur yang benar saat bekerja dengan asam.
Asam Lemah
Tidak semua asam berbahaya. Beberapa asam, seperti asam sitrat yang terdapat pada lemon, asam karbonat dalam minuman bersoda, dan asam asetat dalam cuka masak, adalah contoh asam lemah yang aman untuk dikonsumsi dalam makanan atau minuman.
Basa


Apa Itu Basa?
Basa adalah zat kimia yang dapat memberikan ion hidroksida (OH-) ketika larut dalam air. Berbeda dengan asam yang memiliki rasa masam, basa biasanya memiliki rasa pahit dan merubah warna indikator menjadi biru atau hijau.
Contoh-contoh Basa
Sobat Pintar, mari kita lihat beberapa contoh basa yang sering kita temui:
- Natrium Hidroksida (NaOH): Natrium hidroksida adalah salah satu basa kuat yang digunakan dalam pembuatan sabun, deterjen, dan banyak aplikasi industri lainnya.
- Kalium Hidroksida (KOH): Kalium hidroksida juga merupakan basa kuat yang sering digunakan dalam industri.
- Magnesium Hidroksida (Mg(OH)2): Magnesium hidroksida adalah contoh basa yang digunakan sebagai obat maag.
- Kalsium Hidroksida (Ca(OH)2): Kalsium hidroksida digunakan oleh petani untuk menetralkan tanah yang terlalu asam.
Basa Lemah
Seperti halnya asam, tidak semua basa adalah berbahaya. Beberapa basa lemah, seperti amonia dan natrium karbonat, digunakan dalam berbagai aplikasi sehari-hari seperti pembuatan pupuk, deterjen, dan bahan pembersih. Selain itu, ada juga basa lemah seperti natrium hidrogen karbonat yang digunakan dalam pembuatan soda kue untuk membuat kue yang lezat.
Bahaya Basa Kuat
Basa kuat seperti natrium hidroksida dan kalium hidroksida sangat berbahaya jika tidak ditangani dengan hati-hati. Mereka dapat menyebabkan luka bakar pada kulit dan harus selalu digunakan dengan sarung tangan pelindung.
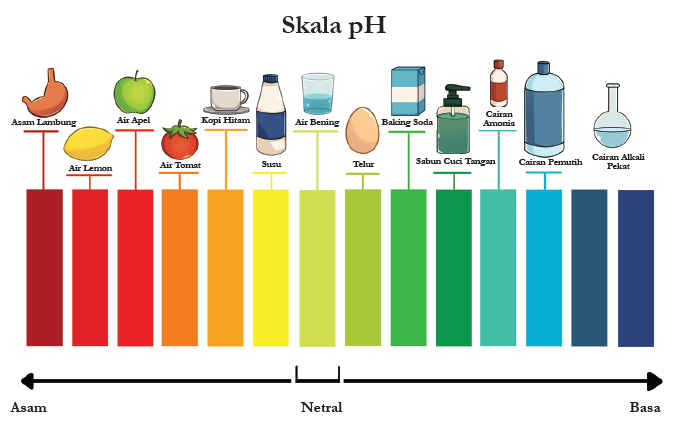
pH dan Indikator

Sobat Pintar, sekarang kita akan membahas tentang pengukuran tingkat keasaman atau kebasaan dalam larutan, yang disebut pH, serta penggunaan indikator untuk mengidentifikasi sifat larutan tersebut.
Apa Itu pH?
pH adalah skala yang digunakan untuk mengukur sejauh mana suatu larutan bersifat asam atau basa. Skala pH berkisar dari 0 hingga 14.
- Larutan dengan pH 0-6 disebut bersifat asam, dimana semakin rendah pH, semakin asam larutan tersebut.
- Larutan dengan pH 7 dianggap netral, yang berarti tidak bersifat asam maupun basa.
- Larutan dengan pH 8-14 disebut bersifat basa, dimana semakin tinggi pH, semakin basa larutan tersebut.
Penggunaan Indikator
Indikator adalah zat kimia yang dapat mengubah warnanya tergantung pada apakah larutan bersifat asam atau basa. Ini adalah alat yang berguna untuk mengidentifikasi sifat suatu larutan tanpa perlu mengukur pH secara tepat.
Beberapa contoh indikator yang sering digunakan adalah:
- Kertas Lakmus: Merah ketika bersentuhan dengan asam dan biru ketika bersentuhan dengan basa.
- Phenolphthalein: Tidak berwarna ketika dalam larutan asam dan berubah merah muda ketika dalam larutan basa.
- Bromtimol Biru: Hijau ketika dalam larutan asam, kuning ketika netral, dan biru ketika dalam larutan basa.
Membuat Indikator Alami
Selain indikator kimia, kita juga dapat membuat indikator alami dari bahan-bahan sehari-hari seperti kunyit, bunga kembang sepatu, buah bit, dan lainnya. Ini adalah cara yang seru untuk belajar kimia dengan bahan-bahan yang ada di sekitar kita!
Reaksi Netralisasi


Sobat Pintar, kita telah mempelajari tentang asam dan basa. Sekarang, mari kita pelajari tentang reaksi netralisasi, sebuah proses kimia menarik yang melibatkan asam dan basa.
Apa Itu Reaksi Netralisasi?
Reaksi netralisasi adalah reaksi kimia antara asam dan basa yang menghasilkan garam dan air sebagai produk. Selama reaksi ini, ion H+ dari asam bereaksi dengan ion OH- dari basa untuk membentuk molekul air (H2O). Sebagai contoh:
Asam klorida + natrium hidroksida --> natrium klorida + air
HCl (aq) + NaOH (aq) --> NaCl (aq) + H2O (l)
Penggunaan Reaksi Netralisasi
Proses netralisasi memiliki banyak aplikasi dalam kehidupan sehari-hari. Beberapa contohnya adalah:
- Pengobatan Maag: Obat maag mengandung basa seperti magnesium hidroksida yang membantu mengurangi keasaman lambung.
- Pertanian: Petani menggunakan kapur (kalsium hidroksida) untuk menetralkan tanah yang terlalu asam sehingga tanaman dapat tumbuh dengan baik.
- Industri: Reaksi netralisasi digunakan dalam industri untuk menghasilkan garam-garam yang digunakan dalam berbagai produk.
1.
Kerjakan soal berikut ini dengan benar!
Apa yang menjadi ciri-ciri utama dari zat asam?
A. Zat asam selalu berbau tajam.
B. Zat asam memiliki pH di bawah 7.
C. Zat asam selalu berwarna merah.
D. Zat asam bersifat abrasif.
JAWABAN BENAR
B.
Zat asam memiliki pH di bawah 7.
PEMBAHASAN
Ciri-ciri utama zat asam adalah memiliki pH di bawah 7.
2.
Kerjakan soal berikut ini dengan benar!
Mana dari berikut ini bukan merupakan sifat asam kuat?
A. Memiliki pH yang rendah.
B. Mudah terionisasi di dalam larutan.
C. Melepaskan ion hidrogen (H+) dengan baik.
D. Tidak bereaksi dengan logam.
JAWABAN BENAR
D.
Tidak bereaksi dengan logam.
PEMBAHASAN
Sifat asam kuat adalah memiliki pH yang rendah, mudah terionisasi di dalam larutan, dan melepaskan ion hidrogen (H+) dengan baik. Asam kuat juga dapat bereaksi dengan logam.
3.
Kerjakan soal berikut ini dengan benar!
Apa yang menjadi ciri-ciri utama dari zat basa?
A. Zat basa memiliki pH di atas 7.
B. Zat basa selalu berwarna biru.
C. Zat basa selalu berbau seperti amonia.
D. Zat basa bersifat korosif.
JAWABAN BENAR
A.
Zat basa memiliki pH di atas 7.
PEMBAHASAN
Ciri-ciri utama zat basa adalah memiliki pH di atas 7.
4.
Kerjakan soal berikut ini dengan benar!
Apa yang terjadi ketika asam dan basa netral bertemu?
A. Terjadi reaksi redoks.
B. Terjadi reaksi netralisasi.
C. Terjadi reaksi oksidasi.
D. Terjadi reaksi substitusi.
JAWABAN BENAR
B.
Terjadi reaksi netralisasi.
PEMBAHASAN
Ketika asam dan basa netral bertemu, terjadi reaksi netralisasi, di mana ion H+ dari asam dan ion OH- dari basa bergabung membentuk air (H2O), dan pH larutan menjadi netral.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

