Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
IPA
Reaksi-Reaksi Kimia dan Dinamikanya
MATERI
Perbedaan Antara Perubahan Fisika dan Perubahan Kimia


Pernahkah Sobat Pintar melihat perbedaan antara perubahan fisika dan perubahan kimia? Mari kita diskusikan bersama.
Perubahan Fisika adalah perubahan yang tidak menghasilkan zat baru. Sebagai contoh, saat kertas disobek-sobek, itu adalah perubahan fisika karena kertas tetap kertas.
Perubahan Kimia, di sisi lain, adalah perubahan yang menghasilkan zat baru. Contoh perubahan kimia adalah saat kertas dibakar, karena kertas menjadi abu yang berbeda dari kertas itu sendiri.
Perbedaan utama antara keduanya adalah bahwa perubahan kimia menghasilkan zat baru dengan sifat yang berbeda, sementara perubahan fisika tidak menghasilkan zat baru.
Pengukuran dalam Reaksi Kimia


Pengukuran adalah aspek penting dalam kimia. Ini membantu kita memahami dan mengukur berbagai parameter yang terlibat dalam reaksi kimia. Dalam sub-modul ini, kita akan membahas pengukuran yang relevan dalam reaksi kimia.
- Massa
Salah satu pengukuran paling dasar dalam kimia adalah pengukuran massa. Massa adalah banyaknya materi dalam suatu objek. Untuk mengukur massa, kita menggunakan alat yang disebut timbangan.
Satuan Massa: Satuan dasar untuk massa adalah gram (g). Dalam beberapa kasus, kita juga menggunakan kilogram (kg) untuk massa yang lebih besar.
- Volume
Volume mengukur seberapa banyak ruang yang diambil oleh suatu objek atau zat. Volume umumnya diukur dalam liter (L) atau mililiter (mL).
Satuan Volume: Satuan dasar untuk volume adalah liter (L), tetapi dalam pengukuran yang lebih kecil, kita menggunakan mililiter (mL), di mana 1 liter sama dengan 1000 mililiter.
- Konsentrasi
Konsentrasi mengukur seberapa banyak zat yang larut dalam pelarut. Ini adalah parameter penting dalam kimia, terutama dalam reaksi larutan. Konsentrasi sering diukur dalam mol per liter (mol/L) atau molaritas (M).
Satuan Konsentrasi: Satuan dasar untuk konsentrasi adalah mol per liter (mol/L). Jika Anda memiliki 1 mol zat yang larut dalam 1 liter pelarut, itu disebut sebagai larutan 1 M.
- Temperatur
Temperatur adalah ukuran sejauh mana suatu zat panas atau dingin. Dalam kimia, suhu biasanya diukur dalam derajat Celcius (°C) atau Kelvin (K). Skala Kelvin lebih umum digunakan dalam perhitungan kimia karena tidak memiliki nilai negatif.
Konversi: Untuk mengkonversi suhu dari derajat Celcius (°C) ke Kelvin (K), Anda cukup menambahkan 273. Jadi, K = °C + 273.
- Tekanan
Tekanan mengukur gaya yang diberikan oleh gas terhadap dinding wadahnya. Satuan umum untuk tekanan adalah atmosfer (atm) atau pascal (Pa).
Satuan Tekanan: 1 atmosfer (atm) setara dengan 101.325 pascal (Pa). Tekanan juga dapat diukur dalam unit lain seperti milimeter raksa (mmHg) atau torr.
- Konversi Satuan
Seringkali, dalam kimia, kita perlu mengkonversi satuan dari satu ke yang lain. Misalnya, mengkonversi massa dari gram ke kilogram atau mengonversi volume dari mililiter ke liter. Untuk melakukan konversi satuan, Anda perlu tahu faktor konversi yang tepat antara satuan-satuan tersebut.
Contoh:
Untuk mengonversi 500 gram menjadi kilogram, kita tahu bahwa 1 kilogram = 1000 gram, jadi 500 gram = 0,5 kilogram.
Pahami dengan baik bagaimana melakukan konversi satuan, karena ini sangat penting dalam berbagai perhitungan kimia.
Persamaan Kimia dan Jenis-Jenis Reaksi

Dalam sub-modul ini, kita akan memahami persamaan kimia dan jenis-jenis reaksi kimia yang umum terjadi.
Persamaan Kimia
Persamaan kimia adalah cara untuk merepresentasikan reaksi kimia dengan menggunakan simbol-simbol dan rumus kimia. Ini membantu kita memahami bagaimana zat-zat bereaksi dan menghasilkan produk-produk tertentu.
Contoh Persamaan Kimia Sederhana:
Reaksi pembentukan air: 2H2(g) + O2(g) --> 2H2O(g)
Dalam persamaan ini, H2 dan O2 adalah pereaksi, sedangkan H2O adalah produk reaksi.
Reaksi pembakaran metana: CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Dalam persamaan ini, CH4 dan O2 adalah pereaksi, sedangkan CO2 dan H2O adalah produk reaksi.
Jenis-Jenis Reaksi Kimia
Reaksi kimia dapat digolongkan ke dalam beberapa jenis berdasarkan apa yang terjadi selama reaksi tersebut. Berikut adalah beberapa jenis reaksi kimia yang umum:
- Reaksi Kombinasi atau Sintesis
Dalam reaksi ini, dua atau lebih zat bergabung untuk membentuk satu produk yang lebih kompleks.
Contoh: Pembentukan garam dapur (NaCl) dari natrium (Na) dan klorin (Cl2).
- Reaksi Penguraian atau Dekomposisi
Dalam reaksi ini, suatu zat kompleks diuraikan menjadi dua atau lebih produk yang lebih sederhana.
Contoh: Penguraian air (H2O) menjadi gas hidrogen (H2) dan gas oksigen (O2) dengan bantuan listrik.

- Reaksi Pembakaran
Dalam reaksi ini, zat-zat bereaksi dengan oksigen (O2) dan melepaskan energi panas.
Contoh: Pembakaran metana (CH4) dalam kehadiran oksigen membentuk karbon dioksida (CO2) dan air (H2O).

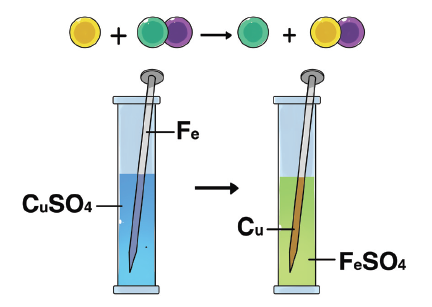
- Reaksi Penggantian Tunggal
Dalam reaksi ini, unsur dalam suatu senyawa digantikan oleh unsur lain untuk membentuk senyawa baru.
Contoh: Pereaksi paku (Fe) digantikan oleh tembaga (Cu) dalam larutan tembaga sulfat (CuSO4), menghasilkan tembaga (Cu) dan besi sulfat (FeSO4).
- Reaksi Pertukaran Ganda atau Metatesis
Dalam reaksi ini, dua senyawa larut dalam air pertukaran anion atau kation untuk membentuk dua senyawa baru.
Contoh: Reaksi antara larutan natrium klorida (NaCl) dan larutan perak nitrat (AgNO3) menghasilkan larutan natrium nitrat (NaNO3) dan endapan perak klorida (AgCl).

Keseimbangan Kimia
Beberapa reaksi kimia dapat mencapai keseimbangan, di mana laju reaksi ke depan dan ke belakang sama. Dalam keseimbangan kimia, jumlah molar pereaksi dan produk tetap konstan, meskipun reaksi masih berlangsung.
Contoh: Reaksi kesetimbangan antara hidrogen (H2) dan nitrogen (N2) membentuk amonia (NH3):
N2(g) + 3H2(g) <=> 2NH3(g)
Pada kesetimbangan ini, laju pembentukan NH3 sama dengan laju dekomposisi NH3, dan konsentrasi masing-masing zat tetap konstan.
1.
Kerjakan soal di bawah ini dengan benar!
Apa yang dimaksud dengan reaksi eksoterm?
A. Reaksi kimia yang memerlukan energi panas.
B. Reaksi kimia yang melepaskan energi panas.
C. Reaksi kimia yang memerlukan energi cahaya.
D. Reaksi kimia yang melepaskan energi cahaya.
JAWABAN BENAR
B.
Reaksi kimia yang melepaskan energi panas.
PEMBAHASAN
Reaksi eksoterm adalah reaksi kimia yang melepaskan energi panas.
2.
Kerjakan soal di bawah ini dengan benar!
Mana dari berikut ini yang merupakan contoh reaksi eksoterm?
A. Penguapan air.
B. Pemanasan es menjadi air.
C. Pembakaran kayu.
D. Pelelehan lilin.
JAWABAN BENAR
C.
Pembakaran kayu.
PEMBAHASAN
Pembakaran kayu adalah contoh reaksi eksoterm karena melepaskan panas.
3.
Kerjakan soal di bawah ini dengan benar!
Apa yang dimaksud dengan energi aktivasi dalam suatu reaksi kimia?
A. Energi yang dilepaskan oleh reaksi.
B. Energi minimum yang diperlukan untuk memulai reaksi.
C. Energi total dari pereaksi.
D. Energi total dari produk.
JAWABAN BENAR
B.
Energi minimum yang diperlukan untuk memulai reaksi.
PEMBAHASAN
Energi aktivasi adalah energi minimum yang diperlukan untuk memulai reaksi kimia.
4.
Kerjakan soal di bawah ini dengan benar!
Faktor apa yang dapat mempengaruhi laju reaksi kimia?
A. Warna larutan.
B. Suhu, banyaknya zat pereaksi, luas permukaan, dan penambahan katalis.
C. Tekanan udara.
D. Bentuk wadah reaksi.
JAWABAN BENAR
B.
Suhu, banyaknya zat pereaksi, luas permukaan, dan penambahan katalis.
PEMBAHASAN
Faktor-faktor yang dapat mempengaruhi laju reaksi kimia meliputi suhu, banyaknya zat pereaksi, luas permukaan, dan penambahan katalis.

Oops!!!
Yah, jawaban kamu meleset nih. Ingin melihat pembahasan soal ini?

BENAR!!!
Selamat!
Jawaban kamu benar. Ingin lihat pembahasan soal ini?
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved

