Belajar Pintar Materi SMP, SMA, SMK
BelajarPintarV3
Sisa Waktu
30
:00
Menit
Detik
Daftar Soal
-
Kategori soal:
1Soal Nomor 1
Belum dikerjakan
-
Kategori soal:
2Soal Nomor 2
Belum dikerjakan
-
Kategori soal:
3Soal Nomor 3
Belum dikerjakan
-
Kategori soal:
4Soal Nomor 4
Belum dikerjakan
-
Kategori soal:
5Soal Nomor 5
Belum dikerjakan
-
Kategori soal:
6Soal Nomor 6
Belum dikerjakan
-
Kategori soal:
7Soal Nomor 7
Belum dikerjakan
-
Kategori soal:
8Soal Nomor 8
Belum dikerjakan
-
Kategori soal:
9Soal Nomor 9
Belum dikerjakan
-
Kategori soal:
10Soal Nomor 10
Belum dikerjakan
-
Kategori soal:
11Soal Nomor 11
Belum dikerjakan
-
Kategori soal:
12Soal Nomor 12
Belum dikerjakan
-
Kategori soal:
13Soal Nomor 13
Belum dikerjakan
-
Kategori soal:
14Soal Nomor 14
Belum dikerjakan
-
Kategori soal:
15Soal Nomor 15
Belum dikerjakan
Pertanyaan 1 DARI
1.
Jawablah soal berikut ini!
Ukuran jumlah zat dalam reaksi kimia umumnya dinyatakan sebagai...
- kJ
- Molaritas
- dHd
- dHf
- dHc
2.
Jawablah soal berikut ini!
Penentuan laju reaksi yang berdasarkan sifat-sifat fisis campuran yang dipengaruhi oleh konsentrasi campuran menggunakan cara...
- Kimia
- Biologi
- Fisika
- Entalpi
- Kekekalan Energi
3.
Jawablah soal berikut ini!
Perhatikan gambar reaksi CaCO3 dalam larutan HCl encer!

Laju reaksi yang hanya dipengaruhi luas permukaan terdapat pada gambar nomor....
- (1) terhadap (2)
- (2) terhadap (3)
- (2) terhadap (4)
- (3) terhadap (5)
- (4) terhadap (5)
4.
Jawablah soal berikut ini!
Perhatikan data laju reaksi pada suhu 25 °C berikut!
Zn (s) + 2HCl (aq) ---> ZnCl2 (aq) + H2 (g)
| Waktu (detik) | 10 | 20 | 30 |
| Volume gas H2 (mL) | 80 | 200 | 320 |
Laju pembentukan gas H2 rata-rata pada suhu tersebut adalah ….
- 8,0 mL/detik
- 10,5 mL/detik
- 11,0 mL/detik
- 11,5 mL/detik
- 12,0 mL/detik
5.
Jawablah soal berikut ini!
Data percobaan laju reaksi
2NO(g) + Br2(g) --->2NOBr(g)

Berdasarkan data di atas, orde reaksi total adalah ….
- 0
- 1
- 2
- 3
- 4
6.
Jawablah soal berikut ini!
Faktor-faktor yang mempengaruhi laju reaksi adalah....
- luas permukaan sentuhan
- konsentrasi zat pereaksi
- suhu saat reaksi berlangsung
- penambahan katalis yang tepat
- 1, 3
- 2, 4
- 1, 4
- 1, 2, 4
- 1, 2, 3, 4
7.
Jawablah soal berikut ini!
Kenaikan suhu menyebabkan reaksi berlangsung dengan cepat, hal itu karena....
- memperbesar luas permukaan
- menaikkan suhu larutan
- memperbesar energi kinetik molekul pereaksi
- memperbesar tekanan
- menaikkan energi pengaktifan zat yang bereaksi
8.
Jawablah soal berikut ini!
Diagram energi untuk suatu reaksi tanpa katalis ditunjukkan oleh grafik di bawah ini.
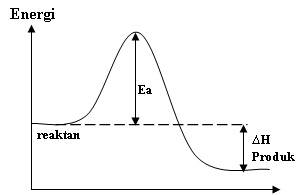
Reaksi tersebut diulang dengan menggunakan suatu katalis. Apakah pengaruh adanya katalis dalam reaksi tersebut terhadap nilai Ea dan delta H ?
- Ea tidak berubah, delta H menurun
- Ea menurun, delta H tidak berubah
- Ea menurun, delta H menurun
- Ea menurun, delta H meningkat
- Ea meningkat, delta H meningkat
9.
Jawablah soal berikut ini!
Pada reaksi A + B --> C diperoleh persamaan laju reaksi v = k [A]2. Dari persamaan laju tersebut dapat disimpulkan bahwa.... kecuali
- laju reaksi dipengaruhi oleh perubahan konsentrasi A.
- orde reaksi atau tingkat reaksi konsentrasi B sama dengan nol.
- laju reaksi tidak dipengaruhi oleh konsentrasi B.
- laju reaksi hasil pereaksi C mempengaruhi laju reaktan B.
- koefisien pereaksi A tidak sama dengan orde reaksi.
10.
Jawablah soal berikut ini!
Pada reaksi 2H2 + 2NO --> 2H2O + N2, eksperimen menyatakan bahwa persamaan laju reaksinya adalah v = k [H2] [NO]2 dengan nilai k = 1 x 10-8. Jika 5 mol H2 dan 2,5 mol NO direaksikan dalam bejana 5 liter, laju reaksinya adalah....
- 2,5 x 10-11
- 2,5 x 10-10
- 2,5 x 10-9
- 2,5 x 10-8
- 2,5 x 10-7
11.
Jawablah soal berikut ini!
Katalis alami yang digunakan dalam pembuatan asam sulfat adalah….
- nikel
- V2O5
- Fe
- zeolit
- Pt
12.
Jawablah soal berikut ini!
Faktor-faktor berikut yang tidak dapat mempercepat laju reaksi adalah….
- konsentrasi awal zat pereaksi
- suhu
- luas permukaan sentuhan
- katalis
- jumlah zat pereaksi
13.
Jawablah soal berikut ini!
Gas A dan gas B bereaksi menurut persamaan berikut.
A (g) + B (g) --> C (g) + D (g)
Pengaruh konsentrasi A dan B terhadap laju reaksi ditemukan sebagai berikut:

Orde reaksi terhadap A adalah...
- 1
- 2
- 3
- 4
- 5
14.
Jawablah soal berikut ini!
Reaksi gas bromin dengan gas nitrogen oksida sesuai dengan persamaan reaksi:
2NO(g) + Br(g) --> 2 NOBr(g)
Berdasarkan hasil dari percobaan diperoleh data sebagai berikut:
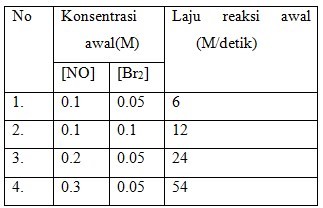
Tentukan orde reaksi terhadap NO….
- x = 9
- x = 6
- x = 5
- x = 3
- x = 2
15.
Jawablah soal berikut ini!
Suatu reaksi pada umumnya akan menjadi lebih cepat berlangsung apabila konsentrasi pereaksinya semakin besar. Penjelasan yang paling tepat dari fakta tersebut adalah….
- semakin besar konsentrasi pereaksi, semakin besar pula energi aktivasinya
- tumbukan antar partikel akan menghasilkan energi yang besar bila konsentrasi pereaksi meningkat
- bertambahnya konsentrasi pereaksi akan menyebabkan orde reaksi bertambah
- semakin besar konsentrasi, peluang terjadinya tumbukan yang menghasilkan reaksi juga semakin besar
- semakin besar konsentrasi akan menyebabkan suhu reaksi juga semakin tinggi

Apakah kamu yakin akan mengakhiri ujian?
Kamu masih ada sisa waktu
40
:50
Menit
Detik
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar adalah perusahaan teknologi informasi yang bergerak dibidang pendidikan, nama perusahaan kami adalah PT. Aku Pintar Indonesia
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved


