Materi Fisika - Termodinamika Kelas 11 - Belajar Pintar
BelajarPintarV3
Peta Belajar Bersama
Halo Sobat Pintar, ini nih apa saja yang akan kita pelajari pada Bab ini..
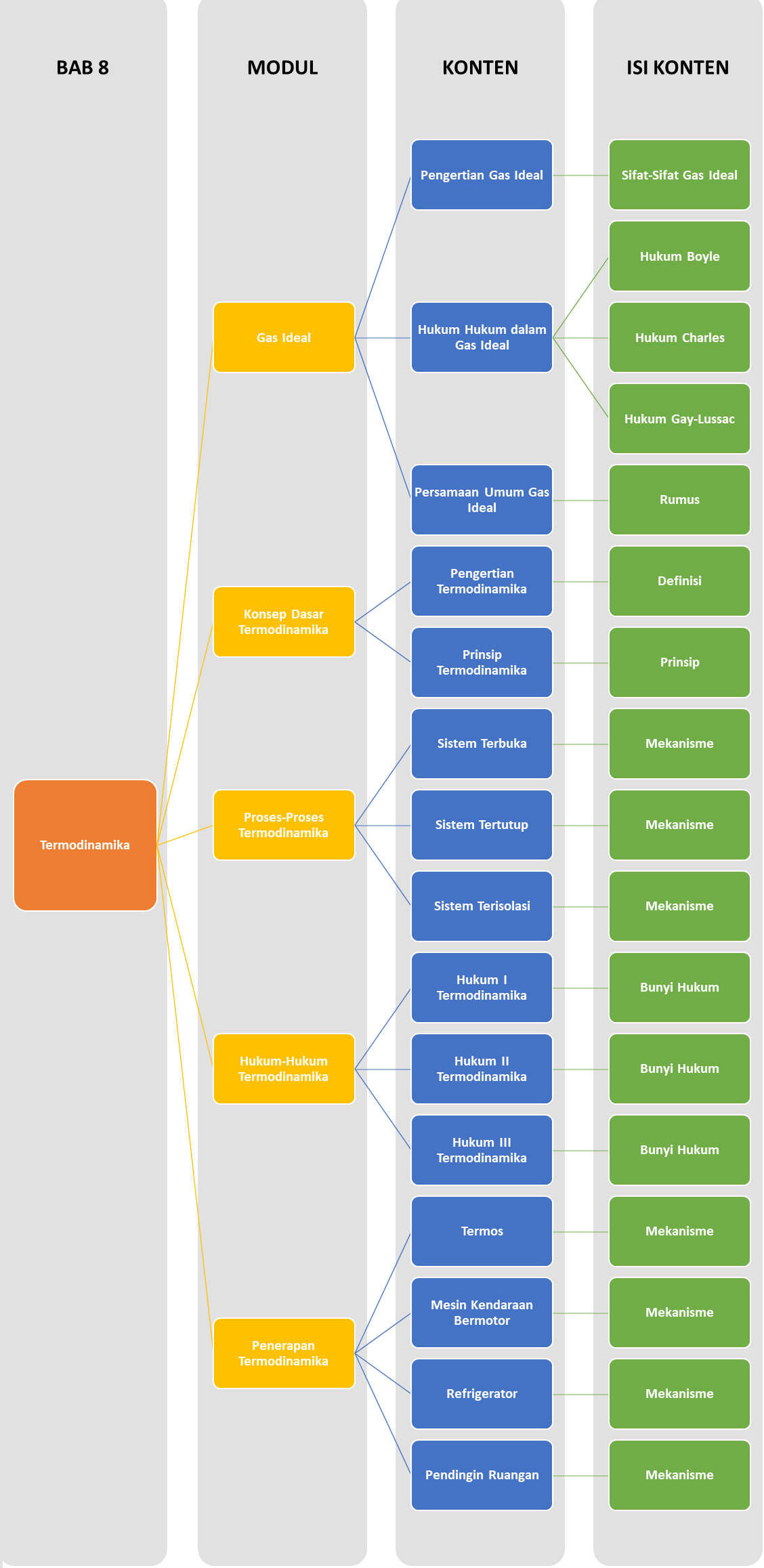
Pengertian Gas Ideal

Gas sejati adalah gas nyata yang ada di sekitar kita. Contohnya yakni gas yang kita hirup, gas yang keluar dari kendaraan bermotor, dan sebagainya. Gas sejati memiliki sifat dan interaksi yang sangat kompleks.
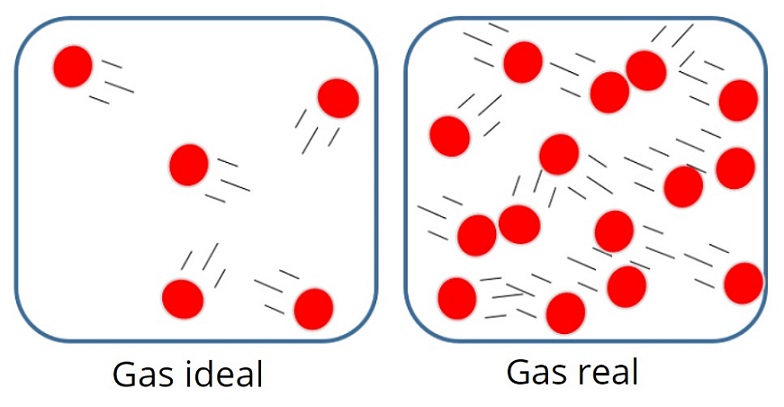
Sementara itu, gas ideal adalah gas teoretik yang digunakan untuk mempelajari perilaku gas. Karena gas sejati bersifat kompleks, maka susah bagi kita untuk mempelajari perilakunya, Oleh karena itu, gas sejati ini disederhanakan menjadi gas ideal. Karena telah disederhanakan, gas ideal pun memiliki sifat dan interaksi yang lebih sederhana dibandingkan gas sejati. Jadi, sederhananya, gas ideal ini adalah model untuk perhitungan perilaku gas sejati atau gas nyata.
Adapun sifat-sifat gas ideal adalah sebagai berikut, sobat :
- Partikelnya berjumlah banyak.
- Tidak ada interaksi antarpartikel atau tidak ada gaya tarik menarik antarpartikelnya.
- Jika dibandingkan ukuran ruangan, ukuran partikel gas ideal bisa diabaikan.
- Tumbukan yang terjadi antara partikel gas dan dinding ruangan merupakan tumbukan lenting sempurna.
- Partikel gas tersebar secara merata di dalam ruangan.
- Partikel gas bergerak secara acak ke segala arah.
- Berlaku Hukum Newton tentang gerak.
- Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu mutlaknya.
Pengertian Termodinamika

Pengertian Termodinamika
Termodinamika berasal dari bahasa Yunani dimana Thermos yang artinya panas dan Dynamic yang artinya perubahan. Termodinamika adalah suatu ilmu yang menggambarkan usaha untuk mengubah kalor (perpindahan energi yang disebabkan perbedaan suhu) menjadi energi serta sifat-sifat pendukungnya.
Termodinamika berhubungan erat dengan fisika energi, panas, kerja, entropi dan kespontanan proses. Termodinamika juga berhubungan dengan mekanika statik. Cabang ilmu fisika ini mempelajari suatu pertukaran energi dalam bentuk kalor dan kerja, sistem pembatas dan lingkungan.
Aplikasi dan penerapan termodinamika bisa terjadi pada tubuh manusia, peristiwa meniup kopi panas, perkakas elektronik, Refrigerator, mobil, pembangkit listrik dan industri.
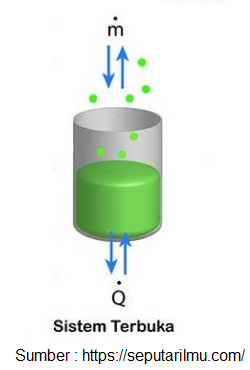
Sistem Terbuka

Sobat Pintar, klasifikasi sistem termodinamika berdasarkan sifat dari batasan dan arus benda, energi dan materi yang melaluinya. Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungannya. Diantaranya yakni sistem terbuka, sistem tertutup dan sistem terisolasi. Untuk pertama adalah sistem terbuka.
Sistem yang menyebabkan terjadinya pertukaran energi (panas dan kerja) dan benda (materi) dengan lingkungannya. Sistem terbuka ini meliputi peralatan yang melibatkan adanya suatu aliran masa kedalam atau keluar sistem seperti pada kompresor, turbin, nozel dan motor bakar. Sistem mesin motor bakar yaitu ruang didalam silinder mesin, dimana campuran bahan bahan bakar dan udara masuk kedalam silinder, dan gas buang keluar sistem.
Pada sistem terbuka ini, baik massa maupun energi bisa melintasi batas sistem yang sifatnya permeabel. Dengan demikian, pada sistem ini volume dari sistem tidak berubah sehingga disebut juga dengan control volume.
Perjanjian yang kita gunakan untuk menganalisis sistem yaitu :
- Untuk panas (Q) bernilai positif jika diberikan kepada sistem dan bernilai negatif bila keluar dari sistem
- Untuk usaha (W) bernilai positif jika keluar dari sistem dan bernilai negatif jika diberikan (masuk) kedalam sistem.
Hukum I Termodinamika (Kekekalan Energi dalam Sistem)

Termodinamika mempunyai hukum-hukum pendukungnya. Hukum-hukum ini menerangkan bagaimana dan apa saja konsep yang harus diperhatikan seperti peristiwa perpindahan panas dan kerja pada proses termodinamika.
Sejak perumusannya, hukum-hukum ini sudah menjadi hukum penting dalam dunia fisika yang berhubungan dengan termodinamika. Penerapan hukum-hukum ini juga digunakan dalam berbagai bidang seperti bidang ilmu lingkungan, otomotif, ilmu pangan, ilmu kimia dan lain-lain.
Energi tidak bisa diciptakan maupun dimusnahkan. Manusia hanya bisa mengubah bentuk energi dari bentuk energi satu ke energi lainnya. Dalam termodinamika, jika sesuatu diberikan kalor, maka kalor tersebut akan berguna untuk usaha luar dan mengubah energi dalam.
Bunyi Hukum I Termodinamika
“Untuk setiap proses apabila kalor Q diberikan kepada sistem dan sistem melakukan usaha W, maka akan terjadi perubahan energi dalam ”.
U = Q - W
Dimana U menunjukkan sifat dari sebuah sistem, sedangkan W dan Q tidak. W dan Q bukan fungsi variabel keadaan, tetapi termasuk dalam proses termodinamika yang bisa merubah keadaan. U merupakan fungsi variabel keadaan (P, V, T, n).
W bertanda positif bila sistem melakukan usaha terhadap lingkungan dan negatif jika menerima usaha lingkungan.
Q bertanda positif jika sistem menerima kalor dari lingkungan dan negatif jika melepas kalor pada lingkungan.
Perubahan energi dari sebuah sistem hanya tergantung pada transfer panas ke dalam sistem dan kerja yang dilakukan oleh sistem dan tidak bergantung pada proses yang terjadi. Pada hukum ini tidak ada petunjuk adanya arah perubahan dan batasan-batasan lain.
- Rumus Hukum Termodinamika I
Secara matematis hukum I termodinamika dapat dirumuskan sebagai berikut:
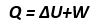
Dengan ketentuan, jika:
Q(+) -> sistem menerima kalor
OR -> sistem melepas kalor
W(+) -> sistem melakukan usaha
W(-) -> sistem dikenai usaha
U(+) -> terjadi penambahan energi dalam
U(-) -> terjadi penurunan energi dalam
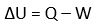
- Proses-proses
Isobaris -> tekanan tetap
Isotermis -> suhu tetap -> U= 0
Isokhoris -> volume tetap (atau isovolumis atau isometric) -> W = 0
Adiabatis -> tidak terjadi pertukaran kalor -> Q = 0
Siklus -> daur -> U = 0
- Persamaan Keadaan Gas
- Hukum Gay-Lussac, Tekanan tetap -> V/T = Konstan -> V1/T1 = V2/T2
- Hukum Charles, Volume tetap -> P/T = Konstan -> P1/T1 = P2/T2
- Hukum Boyle, Suhu tetap -> PV = Konstan -> P1V1 = P2V2
P, V, T Berubah (non adiabatis)
(P1V1) / (T1) = (P2V2) / (T2) - Adiabatis
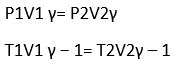
y = perbandingan kalor jenis gas pada tekanan tetap dan volum tetap
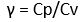
- Usaha
W=PV -> Isobaris
W = 0 -> Isokhoris
W = nRT ln (V2 / V1) -> Isotermis
W = -3/2 nRT-> Adiabatis ( gas monoatomik)
Keterangan :
T = suhu (Kelvin, jangan Celcius)
P = tekanan (Pa = N/m2)
V = volume (m3)
n = jumlah mol
1 liter = 10-3m3
1 atm = 105 Pa
- Mesin Carnot
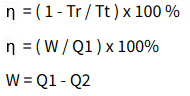

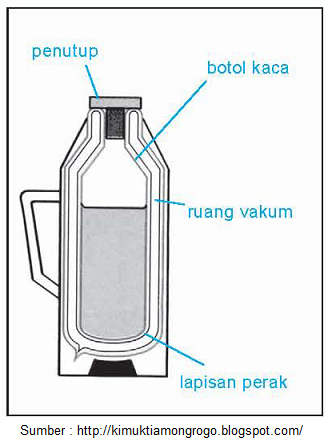
Termos

Pada alat rumah tangga tersebut terdapat aplikasi hukum I termodinamika dengan sistem terisolasi. Dimana tabung bagian dalam termos yang digunakan sebagai wadah air, terisolasi dari lingkungan luar karena adanya ruang hampa udara di antara tabung bagian dalam dan luar. Maka dari itu, pada termos tidak terjadi perpindahan kalor maupun benda dari sistem menuju lingkungan maupun sebaliknya.
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved