Materi Kimia - Reaksi Reduksi Oksidasi dan Tata Nama Senyawa Kelas 10 MIA - Belajar Pintar
BelajarPintarV3
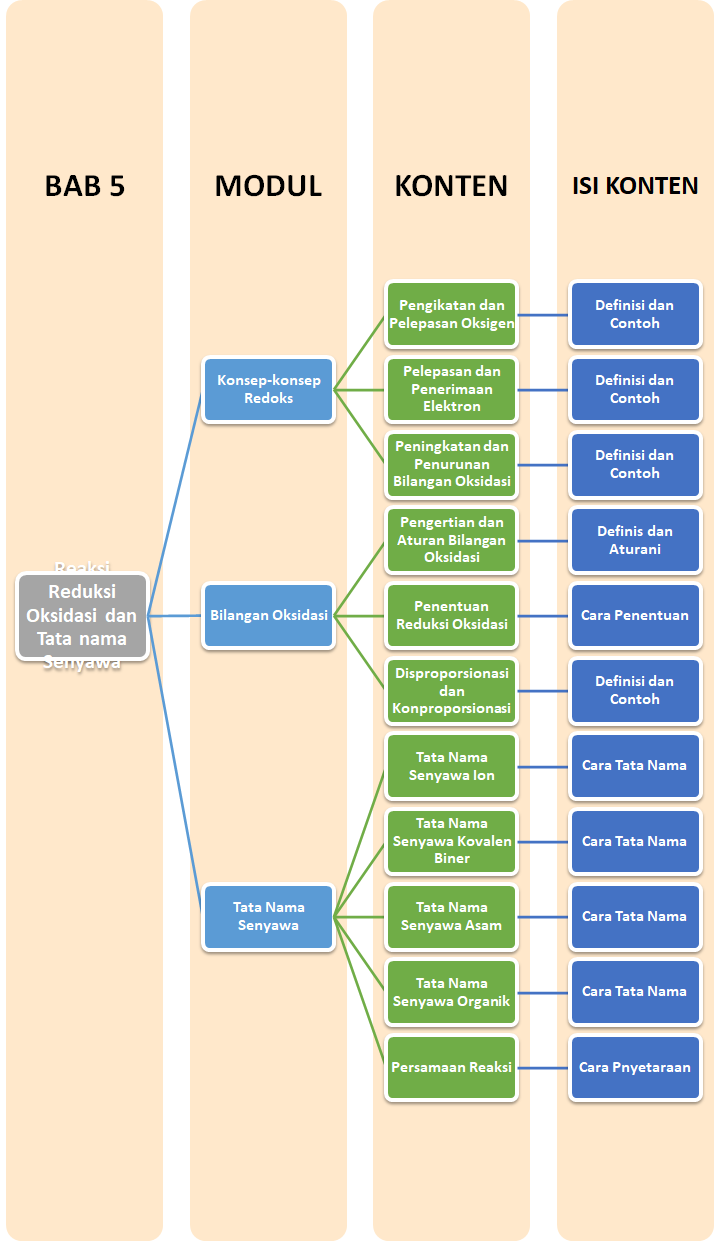
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab kelima.
Yuk, mulai belajar bersama!
Redoks Berdasarkan Pengikatan dan Pelepasan Oksigen

Menurut konsep ini:
- Oksidasi adalah reaksi dimana suatu zat direaksikan dengan sumber oksigen sehingga berikatan dengan oksigen tersebut (membentuk oksida).
- Reduksi adalah reaksi dimana suatu zat berupa oksida direaksikan dengan zat yang menarik oksigen sehingga oksida tersebut kehilangan oksigen.
Dengan kata lain:
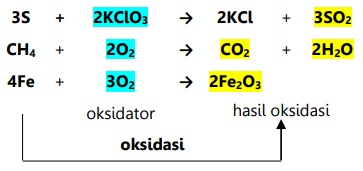
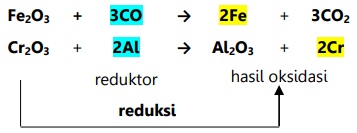
- Oksidasi adalah pengikatan oksigen.
- Reduksi adalah pelepasan oksigen.
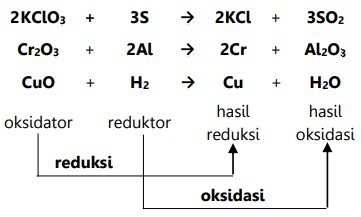
Oksidator adalah sumber oksigen yang mengoksidasi zat lain dan tereduksi.
Reduktor adalah penarik oksigen yang mereduksi zat lain dan teroksidasi.
Contoh oksidasi menurut konsep ini:
Contoh reduksi menurut konsep ini:
Konsep reaksi ini dapat dikatakan sempit karena tidak seluruh reaksi oksidasi melibatkan reduksi, dan tidak seluruh reaksi reduksi melibatkan oksidasi.
Adapun contoh reaksi yang melibatkan reduksi dan oksidasi menurut konsep ini:
Pengertian dan Aturan Bilangan Oksidasi

Bilangan oksidasi senyawa adalah jumlah muatan listrik yang dimiliki atom-atom suatu senyawa, dimana elektron ikatan didistribusikan ke atom yang lebih elektronegatif.
Bilangan oksidasi atom adalah muatan listrik yang dimiliki suatu atom dalam sebuah senyawa.
Contoh: biloks HCl adalah 0, biloks Mg2+ adalah +2, dan biloks F- adalah -1.
Penentuan bilangan oksidasi/biloks atom:
- Unsur bebas di alam memiliki biloks 0.
Contoh: H2, N2, O2, P4, S8, Fe, Mn, Ca. - Ion memiliki biloks yang sama dengan nilai muatannya.
Contoh: ion CO32- memiliki biloks -2, ion Ca2+ memiliki biloks +2. - Unsur logam memiliki biloks positif.
Nilai-nilai biloks logam:
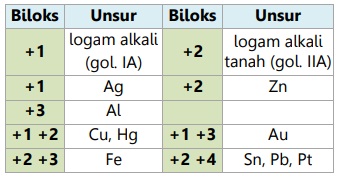
- Unsur fluor (F) selalu memiliki biloks -1.
- Unsur hidrogen (H) memiliki biloks:
Biloks umum H adalah +1.
Contoh: dalam HCl dan H2SO4.
Pada hidrida logam, H memiliki biloks -1.
Contoh: Dalam NaH. - Unsur oksigen (O) memiliki biloks:
Pada senyawa oksida atau umum (mengandung ion O2-).
Contoh: Pada K2O, H2O, Na2O dan MgO.
Pada senyawa peroksida (mengandung ion O22-), oksigen memiliki biloks -1.
Contoh: Pada K2O2, H2O2, Na2O2 dan MgO2.
Pada senyawa superoksida (mengandung ion O2-), oksigen memiliki biloks -1/2.
Contoh: Pada KO2, HO2, NaO2 dan MgO4, biloks oksigen -1/2.
Pada senyawa F2O, oksigen memiliki biloks +2. - Total biloks atom penyusun suatu senyawa:
Pada senyawa netral, total biloks atom penyusun adalah 0.
Pada senyawa ion, total biloks atom penyusun sama dengan muatan ionnya.
Contoh:
Tentukan bilangan oksidasi unsur S pada Na2SO4!
Jawab:
Biloks Na = +1, biloks O = -2.
Total biloks menjadi:
2(b.o. Na) + (b.o. S) + 4(b.o. O) = 0
2(1) + b.o. S + 4(-2) = 0
b.o. S = 8 – 2 = 6
Tata Nama Senyawa Ion

Senyawa ion terdiri dari kation (ion positif) dan anion (ion negatif). Pada umumnya, kation merupakan ion logam dan anion merupakan ion nonlogam.
Kation
- Kation dari unsur logam diberi nama sama dengan unsur logam tersebut.
Contoh:
Ion natrium (Na+), ion kalsium (Ca2+), ion perak (Ag+) - Jika logam dapat membentuk kation dengan muatan berbeda, jumlah muatannya ditulis dengan angka Romawi dalam tanda kurung setelah nama unsur logam itu.
Contoh:
Ion besi(II) (Fe2+), ion besi(III) (Fe3+) - Kation dari unsur nonlogam umumnya memiliki akhiran -ium.
Contoh:
Ion amonium (NH4+), ion hidronium (H3O+)
Berikut merupakan nama-nama kation:
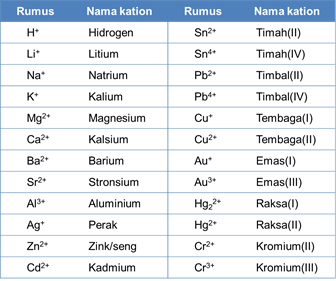
Anion
- Anion monoatom diberi nama dengan akhiran -ida pada nama unsur tersebut.
Contoh:
Ion hidrida (H-), ion oksida (O2-), ion nitrida (N3-), ion fluorida (F-) - Anion poliatom yang mengandung unsur oksigen (oksoanion) diberi nama dengan akhiran -at ataupun -it. Akhiran -at digunakan untuk anion poliatom yang memiliki atom O lebih banyak dibanding anion dengan akhiran -it.
Contoh:
Ion nitrat (NO3-), ion nitrit (NO2-). ion sulfat (SO42-), ion sulfit (SO32-) - Anion yang diturunkan dari penambahan H+ pada oksoanion diberi nama dengan menambahkan awalan hidrogen atau dihidrogen.
Contoh:
Ion hidrogen karbonat (HCO3-), ion dihidrogen fosfat (H2PO4-)
Berikut merupakan nama-nama anion:
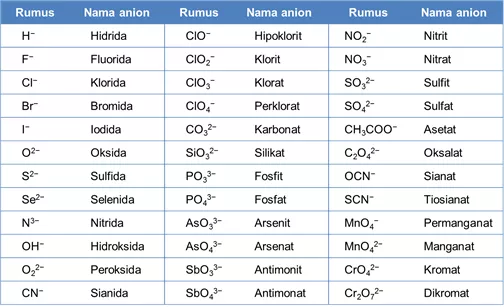
Nama senyawa ion terdiri dari nama kation di awal kemudian diikuti dengan nama anion di akhir.
Contoh :
- KBr : kalium bromida
- BaCl2 : barium klorida
- Ag2S : perak sulfida
- Al(NO3)3 : aluminium nitrat
- FeS : besi(II) sulfida
- Fe2O3 : besi(III) oksida
- CuSO4 : tembaga(II) sulfat
- NH4CN : amonium sianida
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved