Materi Kimia - Struktur Atom dan Sistem Periodik Unsur Kelas 10 MIA - Belajar Pintar
BelajarPintarV3
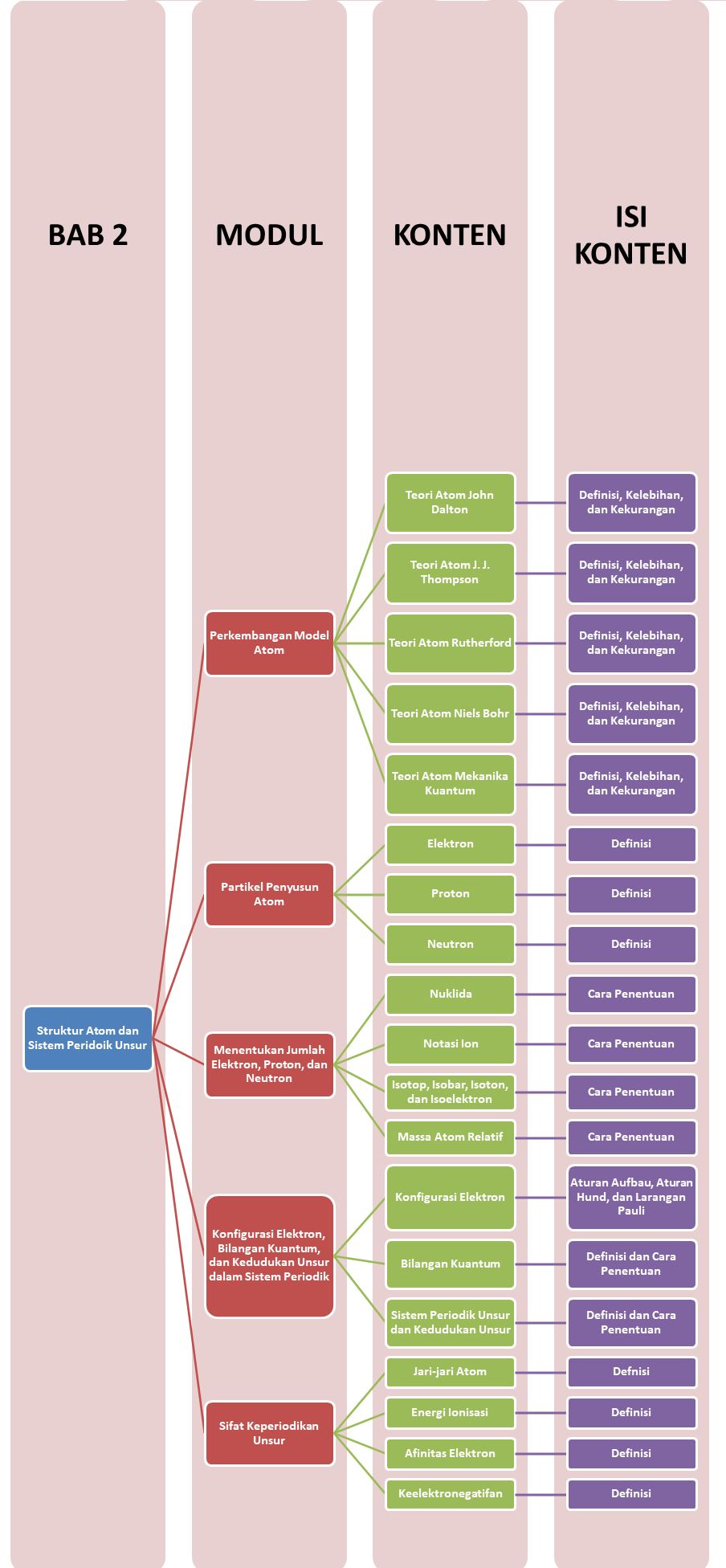
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab kedua.
Yuk, mulai belajar bersama!
Teori Atom John Dalton

Struktur atom adalah susunan partikel dasar dalam atom. Atom sebagai partikel penyusun materi dapat menentukan sifat materi. Atom berasal dari Bahasa Yunani yaitu atomos yang berarti partikel terkecil yang tidak dapat dibagi lagi. Atom memang tidak dapat dilihat dengan kasat mata, namun kita dapat melihat visualisasi atom dalam perkembangan model atom berdasarkan hasil eksperimen dari para ilmuwan. Kebenaran suatu model atau teori atom tidak mutlak. Dalam perkembangannya model atau teori atom terus mengalami perbaikan dan penyempurnaan.
Teori atom John Dalton

Dalton mengemukakan tentang atom sebagai berikut:
- Atom adalah bola pejal yang tidak bermuatan.
- Atom bagian terkecil suatu materi yang tidak dapat dibagi lagi.
- Atom dari suatu unsur yang sama memiliki berat, ukuran, dan bentuk yang sama, tetapi berbeda dengan atom-atom unsur lain.
- Atom tidak dapat diciptakan dan dimusnahkan.
- Pada reaksi kimia terjadi penggabungan dan pemisahan atom.
- Senyawa adalah hasil reaksi atom-atom penyusunnya.
Adapun kelebihan dan kelemahan dari teori atom Dalton, yaitu sebagai berikut:
Kelebihan:
- Meningkatkan rasa minat terhadap penelitian model atom berikutnya.
- Mampu menjelaskan Hukum Kekelalan Massa, Hukum Perbandingan Tetap, dan Hukum Perbandingan Berganda.
Kelemahan:
- Tidak dapat menjelaskan tentang bagaimana cara atom-atom saling berikatan.
- Tidak dapat menjelaskan hubungan antara larutan senyawa dengan daya hantar arus listrik, karena atom merupakan bagian terkecil dari suatu unsur yang tidak bisa dibagi lagi.
- Tidak dapat menjelaskan sifat listrik materi.
- Tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan atom unsur yang lain.
- Belum melibatkan partikel subatomik antaralain proton, elektron, dan neutron.
Poin kunci pada model atom Dalton yaitu, atom merupakan partikel terkecil berbentuk bulat yang tidak bermuatan dan dapat melakukan penggabungan kimia.
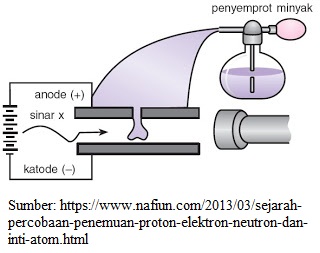
Elektron

Elektron merupakan partikel subatomik bermuatan negatif dengan massa sangat kecil. Elektron ditemukan oleh J.J. Thomson pada tahun 1897 melalui eksperimen dengan tabung sinar katode.
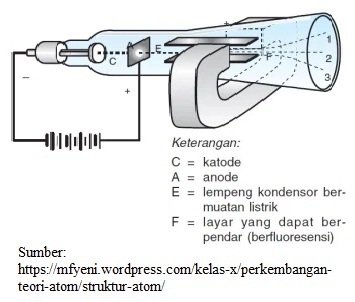
Sifat-sifat sinar katode:
- Merupakan partikel kecil yang tidak dapat dilihat.
- Memiliki sifat cahaya dan sifat materi.
- Merambat tegak lurus dari permukaan katode menuju anode.
- Tidak tergantung pada jenis gas dan jenis elektrode.
- Bermuatan negatif sehingga dalam medan magnet dan medan listrik dibelokkan ke kutub positif.
Sinar katode tersebut merupakan elektron.
Pada tahun 1908 Robert Andrew Milikan menemukan muatan elektron sebesar -1,6 x 10-19 C melalui percobaan tetes minyak. Muatan tersebut diberi tanda -1 dan tidak memiliki massa atau 0 sma.
Nuklida

Nuklida merupakan penulisan lambang suatu unsur secara umum, sebagai berikut.
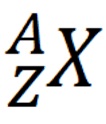
Dengan keterangan sebagai berikut:
X = lambang unsur
Z = nomor atom
A = nomor massa
Nomor atom (Z) menunjukkan banyaknya jumlah proton (p) dalam suatu unsur. Pada atom netral, jumlah proton (p) sama dengan jumlah elektron (e).
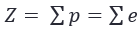
Nomor massa (A) ditentukan oleh jumlah proton (p) dan neutron (n) dalam inti atom.
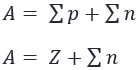
Contoh:
Tentukan jumlah proton, elektron, dan neutron dari notasi unsur berikut!
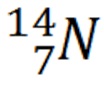
Pembahasan:
Nomor atom = 7, maka
Proton = 7
Elektron = 7
Nomor massa = 14, maka
Neutron = 14 - 7 = 7
Konfigurasi elektron

Konfigurasi elektron adalah susunan elektron dalam suatu atom mulai dari orbital berenergi rendah hingga ke orbital berenergi tinggi.
Menurut Niels Bohr bahwa elektron yang mengelilingi inti akan membentuk lintasan-lintasan yang dikenal dengan nama kulit atom.
Kulit yang terdekat dengan inti disebut kulit K dan merupakan tingkat energi yang paling rendah. Selanjutnya kulit L, M, N dan seterusnya.
Jumlah elektron maksimum yang dapat mengisi setiap kulit adalah 2n2. Dimana n = nomor kulit
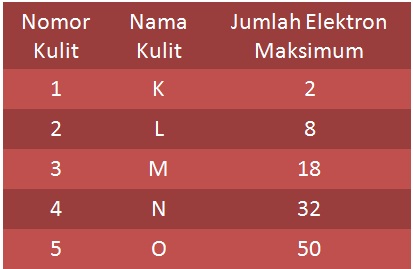
Di dalam kulit tersebut juga dapat dibagi lagi menjadi subkulit dimana dapat menentukan juga jumlah elektron yang terdapat pada orbital atau lintasannya. Aturan penulisan konfigurasinya dituliskan dalam beberapa aturan sebagai berikut:
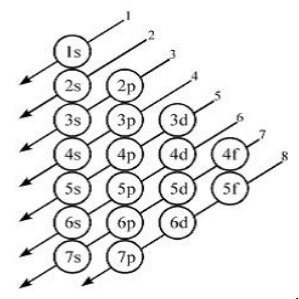
Aturan Aufbau
”Pengisian elektron dalam orbital dimulai dari orbital dengan tingkat energi paling rendah. Setelah penuh, pengisian berlanjut ke orbital yang tingkat energinya satu tingkat lebih tinggi. Demikian seterusnya hingga semua elektron menempati orbital”. Skema energi pada aturan Aufbau digambarkan sebagai berikut:
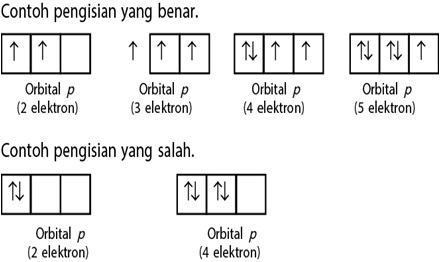
Aturan Hund
”Elektron-elektron yang berada di suatu orbital akan menempati orbital yang kosong dengan arah rotasi sejajar. Setelah itu, elektron-elektron lainnya menempati orbital tersebut dengan arah rotasi yang berlawanan”. Seperti digambarkan pada gambar berikut ini:
Larangan Pauli
”Tidak ada dua buah elektron dalam orbital yang sama memiliki keempat bilangan kuantum yang sama”. Bilangan kuantum spin harus berlawanan dan Jumlah elektron maksimum adalah 2 x jumlah orbital dalam subkulit. Seperti pada gambar berikut:
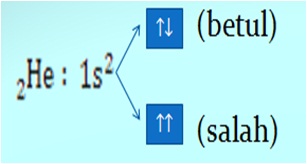
Diagram Orbital dibuat dengan tahapan berikut.
- Menulis konfigurasi elektron berdasarkan aturan Aufbau
- Membuat panah pada subkulit sesuai dengan banyaknya elektron pada orbital yang dimiliki.
Berikut merupakan contoh pengisian elektron pada diagram orbital untuk atom karbon.
6C : 1s2 2s2 2p2
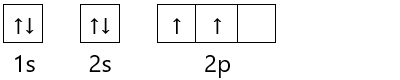
Selain itu, konfigurasi elektron juga dapat menentukan jumlah pada elektron valensi. Elektron valensi adalah jumlah elektron pada subkulit dengan harga n terbesar yang digunakan untuk pembentukan ikatan kimia.
Contoh:
Konfigurasi elektron dari 11Na adalah 1s2 2s2 2p6 3s1, n atau kulit terbesarnya adalah 3 dan pada kulit tersebut hanya terdapat 1 buah elektron, sehingga elektron valensinya sejumlah 1.
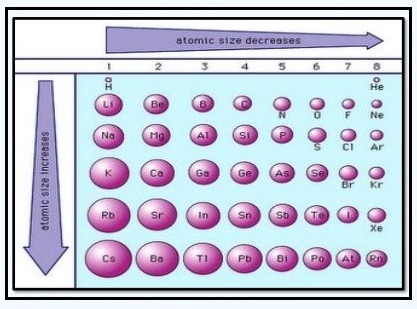
Jari-jari atom

Jari-jari atom adalah jarak yang dihitung dari inti atom hingga lintasan paling luar suatu atom. Dalam satu golongan, jari-jari atom meningkat dari atas ke bawah. Adapun dalam satu periode, jari-jari atom meningkat dari kanan ke kiri. Dalam satu periode, semakin ke kanan jumlah proton dan neutron semakin banyak sehingga gaya tarik inti terhadap elektron terluar semakin kuat sehingga jari-jari atom semakin kecil.
Sifat jari-jari atom dalam sistem periodik unsur digambarkan dalam gambar berikut:
Materi Kimia SMA - 10 MIA Lainnya
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved