Materi Fisika - Teori Kinetik Gas Kelas 11 MIA - Belajar Pintar
BelajarPintarV3
Peta Belajar Bersama

Mengamati Fenomena dalam Teori Kinetik Gas


Gambar 1. Gelembung es | Sumber : https://www.pelajaran.co.id/
Pernahkah sobat melihat gelembung-gelembung ketika minuman bersoda dituangkan? Bagaimana bentuk dan jumlahnya? Gelembung-gelembung minuman bersoda merupakan inti molekul-molekul. Gelembung-gelembung minuman bersoda akan berjumlah banyak dan volumenya semakin membesar saat dituangkan. Hal ini dikarenakan adanya pengaruh tekanan dan jumlah mol dalam minuman tersebut. Fenomena ini merupakan contoh keseharian dari teori kinetik gas.
Pengertian Gas Ideal

Gas sejati adalah gas nyata yang ada di sekitar kita. Contohnya yakni gas yang kita hirup, gas yang keluar dari kendaraan bermotor, dan sebagainya. Gas sejati memiliki sifat dan interaksi yang sangat kompleks.
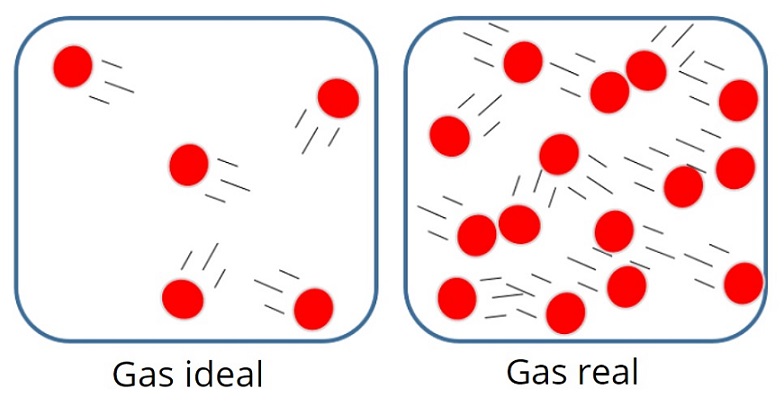
Gambar 1. Ilustrasi Gas Ideal | Sumber : https://www.lifeder.com/gas-ideal/
Sementara itu, gas ideal adalah gas teoretik yang digunakan untuk mempelajari perilaku gas. Karena gas sejati bersifat kompleks, maka susah bagi kita untuk mempelajari perilakunya, Oleh karena itu, gas sejati ini disederhanakan menjadi gas ideal. Karena telah disederhanakan, gas ideal pun memiliki sifat dan interaksi yang lebih sederhana dibandingkan gas sejati. Jadi, sederhananya, gas ideal ini adalah model untuk perhitungan perilaku gas sejati atau gas nyata.
Adapun sifat-sifat gas ideal adalah sebagai berikut, sobat :
- Partikelnya berjumlah banyak.
- Tidak ada interaksi antarpartikel atau tidak ada gaya tarik menarik antarpartikelnya.
- Jika dibandingkan ukuran ruangan, ukuran partikel gas ideal bisa diabaikan.
- Tumbukan yang terjadi antara partikel gas dan dinding ruangan merupakan tumbukan lenting sempurna.
- Partikel gas tersebar secara merata di dalam ruangan.
- Partikel gas bergerak secara acak ke segala arah.
- Berlaku Hukum Newton tentang gerak.
- Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu mutlaknya.
Tekanan Gas Ideal

1. Tekanan Gas Ideal
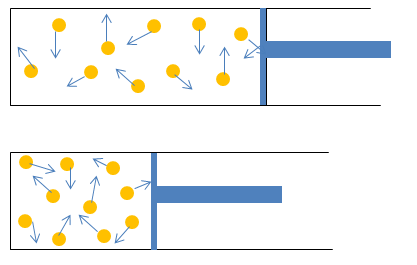
Gambar 1. Tekanan gas pada ruang tertutup | Sumber : http://andriyanilisah.weebly.com/
Keberadaan gas di ruang tertutup bisa mengakibatkan adanya tekanan. Tekanan tersebut disebabkan oleh adanya tumbukan antara partikel gas dan dinding tempat gas berada. Teori kinetik gas menjelaskan bahwa materi terdiri atas sejumlah besar molekul N bermassa m, yang bergerak dengan arah acak, dengan kecepatan bervariasi, serta melakukan tumbukan lenting sempurna satu sama lain dan terhadap dinding wadah.
Persamaan tekanan gas ideal dalam ruang tertutup adalah :
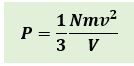
Keterangan :
P= Tekanan gas ideal (N/m2 )
N= Jumlah partikel
m= massa partikel gas (kg)
v= kecepatan rata rata partikel gas (m/s)
V= volume gas (m3)
Karena 1/2 mv2 adalah energi kinetik rata-rata dari partikel-partikel gas, maka persamaan diatas dapat dinyatakan sebagai berikut :
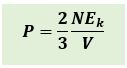

Contoh soal :
Di dalam sebuah bejana yang volumenya 100 cm3 terdapat 5 x 1021 partikel gas. Bila energi kinetik rata-rata translasi masing-masing partikel adalah 6 x 10-21 joule, maka hitunglah tekanan gas di dalam bejana tersebut !
Pembahasan :
V=100 cm3 =1×10-4 m3
N=5×1021 partikel
Ek=6×10-21 joule
P…?
Jawab :
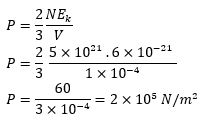
Sehingga, tekanannya adalah 2x105 N/m2
Materi Fisika SMA - 11 MIA Lainnya
Dinamika Rotasi dan Kesetimbangan Benda Tegar
6 Sub Bab Materi

Elastisitas dan Hukum Hooke
5 Sub Bab Materi

Fluida Statis
3 Sub Bab Materi

Fluida Dinamis
3 Sub Bab Materi

Suhu dan Kalor
3 Sub Bab Materi

Termodinamika
5 Sub Bab Materi

Karakteristik Gelombang Mekanik
4 Sub Bab Materi

Gelombang Berjalan dan Stasioner
3 Sub Bab Materi

Gelombang Bunyi
4 Sub Bab Materi

Gelombang Cahaya
7 Sub Bab Materi

Alat - Alat Optik
3 Sub Bab Materi

Gejala Pemanasan Global
3 Sub Bab Materi
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved