Materi Kimia - Kimia Unsur Kelas 12 MIA - Belajar Pintar
BelajarPintarV3
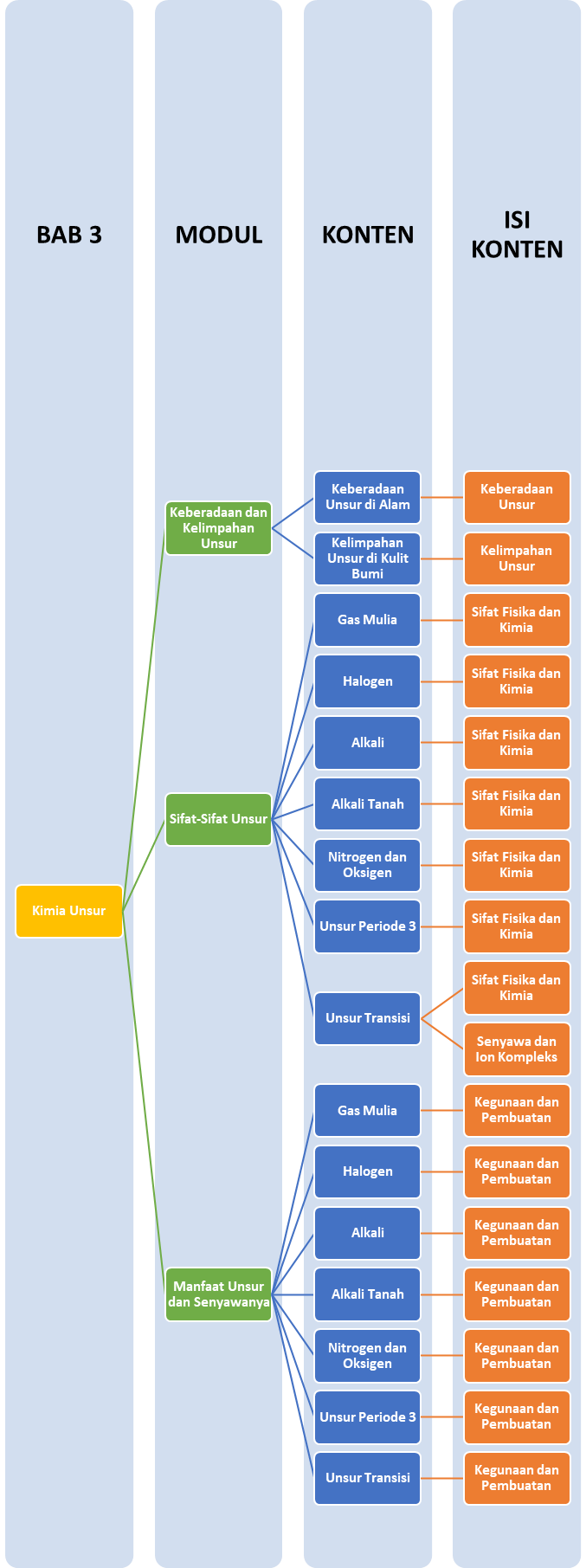
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab ketiga.
Yuk, mulai belajar bersama!
Keberadaan Unsur di Alam

Unsur-unsur di alam lebih banyak berupa senyawa dibandingkan dalam keadaan bebas sesuai bentuk unsurnya. Unsur gas mulia terdapat dalam bentuk bebas dan unsur gas mulia ditemukan dalam bentuk senyawa alami di alam.
Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) termasuk dalam 90 jenis unsur yang terdapat di alam, sedangkan sisanya merupakan unsur buatan seperti plutonium dan amerisium.
Beberapa unsur logam dapat ditemukan dalam keadaan bebas maupun dalam bentuk senyawa seperti emas, perak, platina, dan tembaga.
Unsur nonlogam yang ditemukan dalam keadaan bebas dan dalam bentuk senyawa seperti oksigen, belerang, nitrogen, dan karbon. Unsur atau senyawa yang banyak terdapat dalam bahan-bahan alam disebut mineral. Mineral diolah untuk diambil unsurnya, sehingga dapat digunakan dalam kehidupan sehari-hari.
Berikut ini merupakan keberadaan unsur-unsur yang ditemukan di alam dalam senyawa kelompok golongan utama:

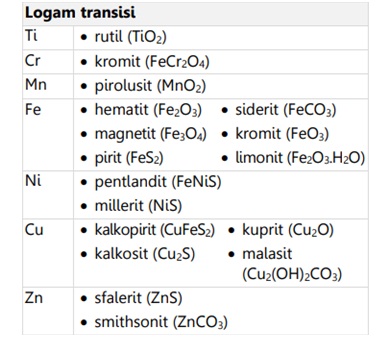
Pada logam transisi atau golongan B, unsur-unsur tersebut ditemukan dalam mineral sebagai berikut:
Gas Mulia

Gas Mulia
Unsur gas mulia berada pada golongan VIIIA dan terdiri dari:
- helium (He),
- neon (Ne),
- argon (Ar),
- kripton (Kr),
- xenon (Xe),
- radon (Rn).
Gas mulia mendapatkan namanya karena pada suhu ruangan, wujudnya berupa gas dan bersifat sangat stabil atau sulit bereaksi. Gas mulia sering ditemukan berupa atom tunggal di alam.
Sifat Fisis
Sifat fisis gas mulia antara lain adalah titik leleh dan titik didih yang sangat rendah. Titik didihnya mendekati nol derajat Kelvin dan titik didihnya hanya beberapa derajat di atas titik lelehnya. Gas mulia hanya akan mencair atau memadat jika energi molekul-molekulnya sangat lemah, yaitu pada suhu yang sangat rendah.
Berikut adalah sifat fisik dari unsur gas mulia:
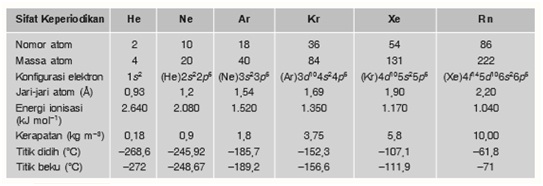
Sifat kimia
- Kulit terluarnya sudah penuh sehingga bersifat stabil.
- Gas mulia sukar bereaksi (bersifat inert) karena konfigurasi elektronnya stabil sehingga jarang ditemukan dalam bentuk senyawa.
- Sangat inert, hanya beberapa senyawa yang dapat dibentuk. Senyawa tersebut adalah XeF2, XeF4, dan XeF6.
- Gas mulia sedikit larut dalam air, kecuali helium dan neon karena ukuran atomnya terlalu kecil.
Gas Mulia

Kegunaan:
Helium (He)
- Pengisi balon udara yang ringan.
- Isi tabung penyelam (80% He, 20% O).
- Pendingin reaktor nuklir.
- Pencipta lingkungan inert.
Neon (Ne)
- Pengisi tube lamp
- reklame dan TV tabung.
- Pendingin reaktor nuklir.
- Lampu runway bandar udara.
Argon (Ar)
- Pengisi tube lamp dan bola lampu dengan kawat tungsten.
- Pencipta lingkungan inert.
Kripton (Kr)
- Pengisi lampu fluorosense, mercusuar dan runway bandar udara.
- Lampu kilat (flashtube) kamera.
Xenon (Xe)
- Pembuatan tabung elektron.
- Pembiusan pada bedah.
- Lampu blitz pada kamera.
Radon (Rn)
- Terapi radiasi penderita kanker.
Pembuatan:
- Ekstraksi dari gas alam (He)
- Proses kriogenik (He)
- Proses adsorpsi (He, Ar, Kr, dan Xe)
- Ekstraksi dari udara (He, Ne, Ar, Kr, dan Xe)
- Proses destilasi fraksional (Ar, Kr, dan Xe)
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved