Materi Kimia - Reaksi Redoks dan Elektrokimia Kelas 12 MIA - Belajar Pintar
BelajarPintarV3
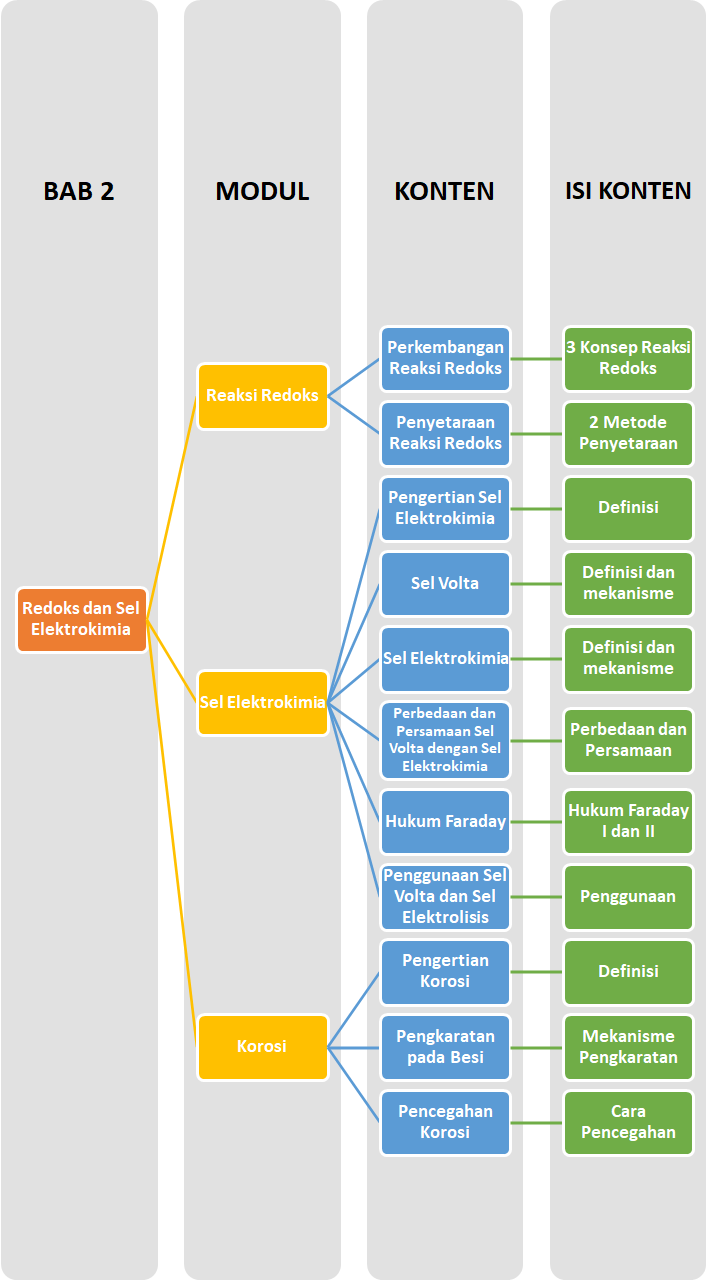
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab kedua.
Yuk, mulai Belajar Bersama!
Perkembangan Konsep Reaksi Redoks

Konsep Reaksi Redoks Berdasarkan Pengikatan dan Pelepasan Oksigen
Pada awalnya, sekitar abad ke-18, konsep reaksi oksidasi dan reduksi didasarkan atas penggabungan unsur atau senyawa dengan oksigen membentuk oksida, dan pelepasan oksigen dari senyawa.
Adapun yang dimaksud dengan reaksi reduksi dan oksidasi adalah sebagai berikut.
Reduksi adalah reaksi pelepasan oksigen dari suatu senyawa.
Reduktor adalah:
- Zat yang menarik oksigen pada reaksi reduksi.
- Zat yang mengalami reaksi oksidasi.
Contoh:
- Reduksi Fe2O3 oleh CO
Fe2O3 + 3CO ---> 2Fe + 3CO2 - Reduksi Cr2O3 oleh Al
Cr2O3 + 2Al ---> 2Cr + Al2O3
Oksidasi adalah reaksi pengikatan (penggabungan) oksigen oleh suatu zat.
Oksidator adalah:
- Sumber oksigen pada reaksi oksidasi.
- Zat yang mengalami reduksi.
Contoh:
- Oksidasi Fe oleh O2
4Fe + 3O2 ---> 2Fe2O3 - Pemanggangan ZnS
2ZnS + 3O2 ---> 2ZnO + 2SO2
Konsep Reaksi Redoks Berdasarkan Pelepasan dan Penerimaan Elektron
Reaksi oksidasi dan reduksi ternyata bukan hanya melibatkan oksigen, melainkan juga melibatkan elektron. Memasuki abad ke-20, para ahli melihat suatu karakteristik mendasar dari reaksi oksidasi dan reduksi yang ditinjau dari ikatan kimianya, yaitu adanya serah terima elektron. Konsep ini dapat diterapkan pada reaksi-reaksi yang tidak melibatkan oksigen.
Adapun yang dimaksud dengan reaksi reduksi dan oksidasi adalah sebagai berikut:
Reduksi adalah reaksi pengikatan elektron.
Reduktor adalah:
- Zat yang melepaskan elektron.
- Zat yang mengalami oksidasi.
Contoh:
- Cl2 + 2e- ---> 2Cl-
- Ca2+ + 2e- ---> Ca
Oksidasi adalah reaksi pelepasan elektron.
Oksidator adalah:
- Zat yang mengikat elektron.
- Zat yang mengalami reduksi.
Contoh:
- K ---> K+ + e-
- Cu ---> Cu2+ + 2e-
Konsep Reaksi Redoks Berdasarkan Pertambahan dan Penurunan Bilangan Oksidasi
Reaksi redoks dapat pula ditinjau dari perubahan bilangan oksidasi atom atau unsur sebelum dan sesudah reaksi. Reaksi redoks adalah reaksi yang ditandai dengan terjadinya perubahan bilangan oksidasi (biloks) dari atom unsur sebelum dan sesudah reaksi. Sebelum membahas konsep reaksi reduksi oksidasi berdasarkan perubahan bilangan oksidasi, ada baiknya kita bahas terlebih dahulu apa yang dimaksud dengan bilangan oksidasi itu.
Bilangan Oksidasi
Bilangan oksidasi atau biloks adalah muatan yang dimiliki oleh atom jika elektron valensinya cenderung tertarik ke atom lain yang berikatan dengannya dan memiliki keelektronegatifan lebih besar.
Aturan penentuan bilangan oksidasi antara lain sebagai berikut:
Jumlah bilangan oksidasi atom dalam unsur bebas sama dengan 0 (nol).
Contoh:
Bilangan oksidasi atom dalam unsur Na, Fe, H2, P4, dan S8 sama dengan 0 (nol).
Jumlah bilangan oksidasi ion monoatom sama dengan muatan ionnya.
Contoh:
- Bilangan oksidasi ion Na+ sama dengan +1.
- Bilangan oksidasi ion Mg2+ sama dengan +2.
- Bilangan oksidasi ion Fe3+ sama dengan +3.
- Bilangan oksidasi ion Br- sama dengan -1.
- Bilangan oksidasi ion S2- sama dengan -2.
Jumlah bilangan oksidasi semua atom dalam senyawa netral sama dengan 0 (nol).
Contoh:
Senyawa NaCl mempunyai muatan = 0.
Jumlah biloks Na + biloks Cl = (+1) + (-1) = 0.
Jumlah bilangan oksidasi semua atom dalam ion poliatomik sama dengan muatan ionnya.
Contoh:
Ion NO3- bermuatan = -1, maka biloks N = -1 dan biloks O = -1.
Jumlah bilangan oksidasi unsur dari golongan IA adalah +1 dan unsur dari golongan IIA adalah +2, dan golongan IIIA adalah +3
Contoh:
Bilangan oksidasi Na dalam NaCl, Na2SO4, dan Na2O adalah +1.
Bilangan oksidasi Ca dalam CaCl2, CaSO4, dan CaO adalah +2.
Bilangan oksidasi Al dalam Al2O3 adalah +3.
Jumlah bilangan oksidasi unsur golongan VIA pada senyawa biner adalah -2 dan unsur golongan VIIA pada senyawa biner adalah -1.
Contoh:
Bilangan oksidasi S dalam Na2S dan MgS adalah -2.
Bilangan oksidasi Cl dalam NaCl, KCl, MgCl2, dan FeCl3 adalah -1.
Jumlah bilangan oksidasi unsur H yang berkaitan pada senyawa logam adalah +1, apabila berkaitan dengan senyawa non-logam -1.
Contoh:
Bilangan oksidasi H dalam H2O, HCl, H2S, dan NH3 adalah +1.
Bilangan oksidasi H dalam NaH, CaH2 adalah -1.
Jumlah bilangan oksidasi oksigen (O) dalam senyawa peroksida = -1. Bilangan oksidasi O dalam senyawa non-peroksida = -2.
Contoh:
Bilangan oksidasi O dalam senyawa peroksida, seperti H2O2 dan BaO2 adalah -1.
Bilangan oksidasi O dalam H2O adalah -2
Nah sekarang udah inget lagi kan tentang konsep pada Reaksi Redoks, habis ini kita belajar tentang Penyetaraan Reaksi Redoks
Pengertian Sel Elektrokimia

Sel elektrokimia adalah tempat terjadinya aliran elektron yang ditimbulkan oleh konversi energi kimia menjadi energi listrik atau sebaliknya. Hal ini dimungkinkan dengan pemisahan reaksi oksidasi dan reaksi reduksi (reaksi redoks).
Sel elektrokimia adalah suatu alat yang menghasilkan arus listrik dari energi yang dihasilkan oleh reaksi di dalam selnya, yaitu reaksi oksidasi dan reaksi reduksi (reaksi redoks). Sel elektrokimia tersusun dari dua material penghantar atau konduktor listrik yang disebut dengan katoda dan anoda. Kedua material penghantar ini disebut dengan elektroda.
Anoda merupakan elektroda tempat terjadinya reaksi oksidasi, sedangkan katoda adalah elektroda tempat terjadinya reaksi reduksi. Reaksi oksidasi adalah reaksi yang menghasilkan kenaikan bilangan oksidasi, sedangkan reaksi reduksi adalah reaksi yang menghasilkan penurunan bilangan oksidasi.
Bilangan oksidasi menunjukkan jumlah total elektron yang telah dipindahkan dari suatu unsur (hal ini akan menghasilkan bilangan oksidasi positif) dan jumlah total elektron yang telah ditambahkan ke dalam suatu unsur (menghasilkan bilangan oksidasi negatif) untuk mencapai keadaan yang baru.
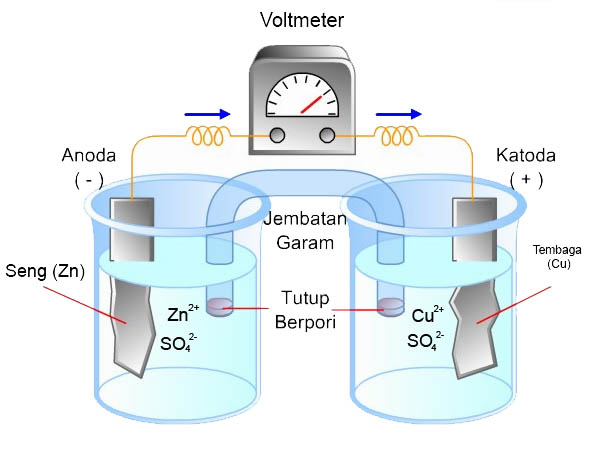
Skema Sel Daniell
Sel Daniell adalah sel elektrokimia yang menggunakan seng (Zn) sebagai anoda dan tembaga (Cu) sebagai katoda. Seng dicelupkan ke dalam seng sulfat (ZnSO4), sedangkan tembaga dicelupkan ke dalam tembaga sulfat (CuSO4).
Pengertian Korosi


Korosi adalah kerusakan atau degradasi logam akibat reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa sehari-hari, korosi disebut perkaratan. Contoh korosi yang paling lazim adalah perkaratan besi.
Pada peristiwa korosi, logam mengalami oksidasi, sedangkan oksigen (udara) mengalami reduksi, Karat logam umumnya adalah berupa oksida atau karbonat. Rumus kimia karat besi adalah Fe2O3.nH2O, suatu zat padat yang berwarna coklat-merah.
Korosi merupakan proses elektrokimia. Pada korosi besi, bagian tertentu dari besi itu berlaku sebagai anoda, di mana besi mengalami oksidasi.
Fe(s) <==> Fe2+(aq) + 2e-
Elektron yang dibebaskan di anode mengalir ke bagian lain dari besi itu yang bertindak sebagai katode, di mana oksigen tereduksi.
O2(g) + 4H+(aq) + 4e- <==> 2H2O(l)
atau
O2(g) + 2H2O(l) + 4e- <==> 4OH-(aq)
Ion besi(II) yang terbentuk pada anode selanjutnya teroksidasi membentuk ion besi(III) yang kemudian membentuk senyawa oksida terhidrasi, yaitu karat besi.
Mengenai bagian mana dari besi itu yang bertindak sebagai anode dan bagian mana yang bertindak sebagai katode, bergantung pada berbagai faktor, misalnya zat pengotor, atau perbedaan rapatan logam itu.
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved