Materi Kimia - Sifat Koligatif Larutan Kelas 12 MIA - Belajar Pintar
BelajarPintarV3
Peta Belajar Bersama
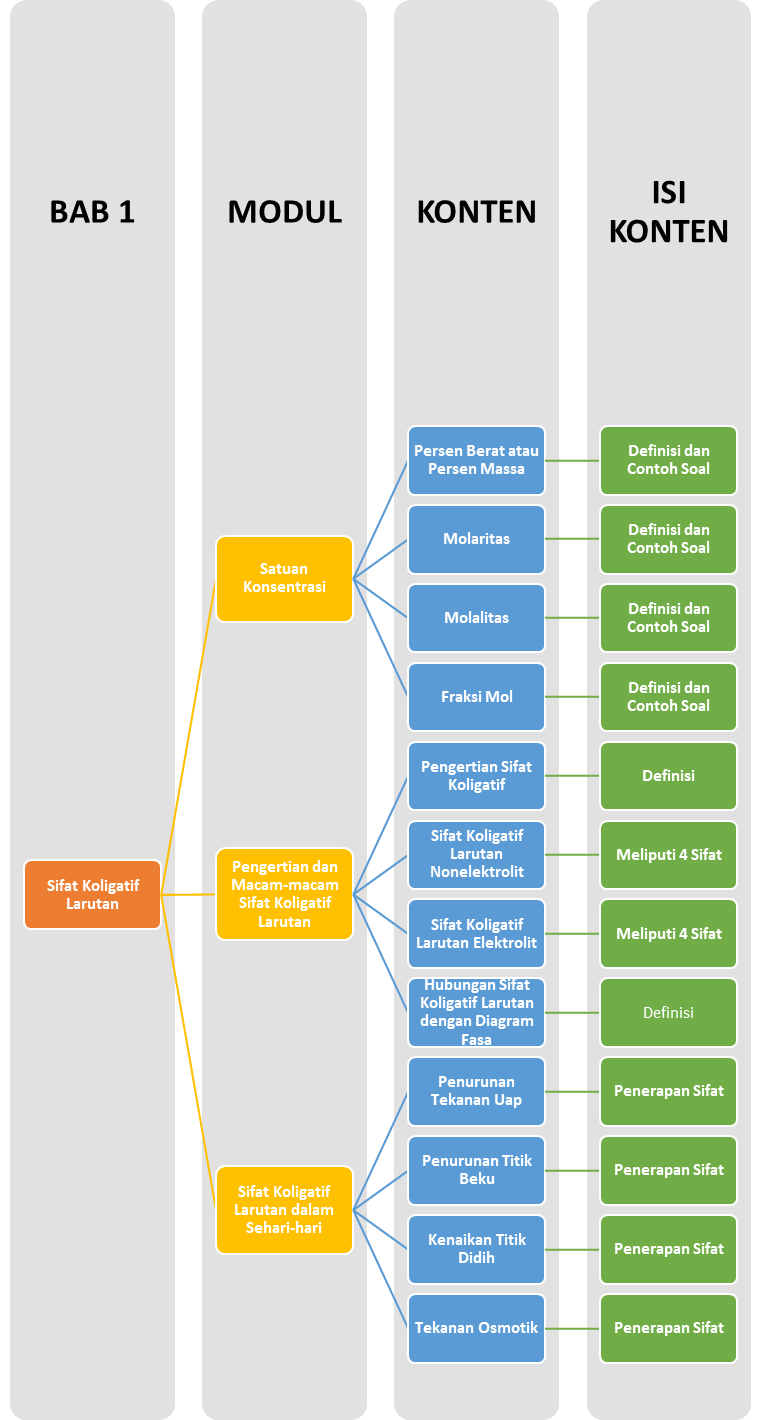
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab pertama.
Yuk, mulai belajar bersama!
Persen Berat atau Persen Massa

Persen Berat atau Persen Massa
Bila menyatakan persen berat, persentase yang diberikan itu merujuk ke zat terlarut. Pernyataan “5,00 g NaCl per 100,0 g larutan berair” mempunyai pengertian : Larutan yang dibuat dari 5,00 g NaCl dan melarutkannya dalam 95,0 g H2O, yaitu massa air yang cukup untuk menghasilkan 100,0 gr larutan. Larutan ini dapat dikatakan larutan “5% NaCl berdasar massa".
Satuan konsentrasi ini, yang kuantitas terlarut dan larutannya diukur berdasar massa, juga dinamakan persen massa/massa atau %(massa/massa).
Persen massa dapat didefinisikan dengan persamaan :

Contoh soal:
Hitunglah berapa persen massa pada 20 gram magnesium hidroksida yang dilarutkan dalam 140 gram air!
Penyelesaian:

Sehingga persen massa dari 20 gram magnesium hidroksida dalam 140 gram air sebesar 12,5%.
Larutan Elektrolit

Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Dalam larutan elektrolit molekul-molekulnya terurai (terdisosiasi) menjadi partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif-ion negatif). Ion positif yang dihasilkan dinamakan kation dan ion negatif yang dihasilkan dinamakan anion.
Larutan elektrolit dapat menghantarkan listrik karena:
- Pada senyawa ionik, larutan terion menjadi ion-ion bermuatan listrik yang bergerak bebas menghantarkan listrik.
Contoh: NaCl --> Na+ + Cl-
Dapat menghantarkan listrik dalam bentuk larutan dan lelehan. - Pada senyawa kovalen polar, larutan terion akibat gaya tarik antar molekul yang memutuskan ikatan atom molekul.
Contoh: CH3COOH --> CH3COO- + H+
Dapat menghantarkan listrik dalam bentuk larutan. Lelehannya tidak dapat menghantarkan listrik.
Larutan elektrolit dapat dikelompokkan menjadi larutan elektrolit kuat dan larutan elektrolit lemah.
Larutan Elektrolit Kuat
Yaitu larutan yang semua molekulnya terurai menjadi ion-ion (terionisasi sempurna). Oleh karena banyaknya ion-ion penghantar listrik yang terbentuk, maka daya hantarnya juga kuat. Umumnya larutan elektrolit kuat adalah larutan garam.
Ciri-ciri dari elektrolit kuat yaitu sebagai berikut :
- Terionisasi sempurna
- Mempunyai daya hantar listrik yang baik
- Derajat ionisasi

- Uji lampu dan gelembung:
Lampu nyala terang
Menghasilkan banyak gelembung - Biasanya berupa asam kuat, basa kuat dan garam yang kation dan anionnya dari asam dan basa kuat
Contohnya:
- Garam (NaCl, KCl, CuSO4 dan KNO3)
- Asam kuat (HCl, HI, HBr, H2SO4 dan HNO3)
- Basa kuat (NaOH, KOH, Mg(OH)2, dan Ca(OH)2)
Contoh reaksi penguraian elektrolit kuat:
NaCl(aq) ---> Na+(aq) + Cl–(aq)
H2SO4(aq) ---> 2H+(aq) + SO42-(aq)
Larutan Elektrolit Lemah
Yaitu larutan yang tidak semua molekulnya terionisasi (ionisasi tidak sempurna), sehingga hanya sedikit ion-ion yang dapat menghantarkan listrik.
Ciri-ciri dari elektrolit lemah yaitu sebagai berikut :
- Terionisasi sebagian
- Mempunyai daya hantar listrik yang kurang baik atau lemah
- Derajat ionisasi
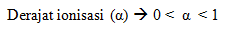
- Uji lampu dan gelembung:
Lampu nyala redup
Menghasilkan sedikit gelembung - Biasanya berupa asam lemah dan basa lemah
Contohnya:
- Asam lemah (HCN, H3PO4, CH3COOH dan H2CO3),
- Basa lemah (NH4OH, Al(OH)3 dan Fe(OH)3)
Contoh reaksi penguraian elektrolit lemah:
CH3COOH(aq) --> CH3COO-(aq) + H+(aq)
Pengertian Sifat Koligatif

Dalam larutan sendiri terdapat 2 komponen utama pembentuk larutan, yaitu zat terlarut dan zat pelarut (biasanya air). Hubungannya dengan sifat koligatif adalah banyaknya jumlah mol zat terlarut dalam larutan tersebut.
Sifat koligatif bergantung pada jumlah zat yang terlarut pada larutan. Sifat koligatif terdiri atas penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.

Menurut hukum sifat koligatif, selisih tekanan uap, titik beku, dan titik didih suatu larutan dengan tekanan uap, titik beku, dan titik didih pelarut murninya, berbanding langsung dengan konsentrasi zat terlarut. Larutan yang bisa memenuhi hukum sifat koligatif ini disebut larutan ideal. Kebanyakan larutan mendekati ideal hanya jika sangat encer.
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergantung pada jumlah zat terlarut yang larut pada suatu larutan.
Penurunan Tekanan Uap

Sobat, coba deh kalian perhatikan gambar di bawah ini, kok bisa ya orang bisa mengapung di atas air ?
Fenomena di bawah ini terjadi di laut mati Sobat.

Molekul–molekul zat cair yang meninggalkan permukaan menyebabkan adanya tekanan uap zat cair. Semakin mudah molekul–molekul zat cair berubah menjadi uap, makin tinggi pula tekanan uap zat cair.
Apabila tekanan zat cair tersebut dilarutkan oleh zat terlarut yang tidak menguap, maka partikel–partikel zat terlarut ini akan mengurangi penguapan molekul–molekul zat cair.
Laut mati adalah contoh dari terjadinya penurunan tekanan uap pelarut oleh zat terlarut yang tidak mudah menguap. Air berkadar garam sangat tinggi ini terletak di daerah gurun yang sangat panas dan kering, serta tidak berhubungan dengan laut bebas, sehingga konsentrasi zat terlarutnya semakin tinggi.
Pada saat berenang di laut mati, kita tidak akan tenggelam karena konsentrasi zat terlarutnya yang sangat tinggi. Hal ini tentu saja, dapat dimanfaatkan sebagai sarana hiburan atau rekreasi bagi manusia. Penerapan prinsip yang sama dengan laut mati dapat kita temui di beberapa tempat wisata di Indonesia yang berupa kolam apung.
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved