Materi Kimia - Kelarutan dan Hasil Kali Kelarutan Kelas 11 MIA - Belajar Pintar
BelajarPintarV3
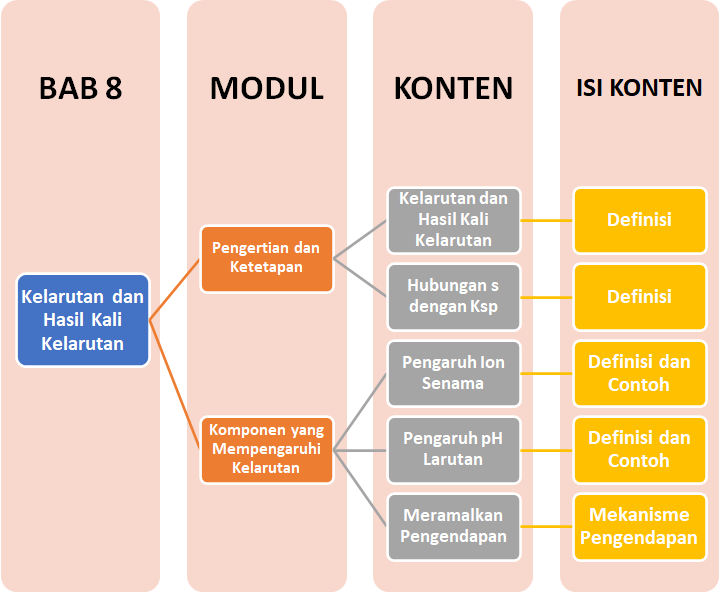
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab kedelapan.
Yuk, mulai belajar bersama!
Kelarutan dan Hasil Kali Kelarutan

Kelarutan (s)
Adalah jumlah maksimum zat yang dapat larut dalam sejumlah pelarut tertentu.
Kelarutan dapat dihitung:

Konstanta hasil kali kelarutan (Ksp)
Adalah tetapan kesetimbangan yang terdapat pada basa dan garam yang sukar larut. Pelarutan zat tergolong reaksi kesetimbangan yang terjadi antara zat padat dengan ionnya.
Bentuk umum konstanta hasil kali kelarutan:
Ksp = [Kation+]x[Anion–]y
Dengan x dan y adalah konstanta suatu senyawa
Contoh:
Konstanta hasil kali kelarutan CaCO3 adalah:
CaCO3(aq) <==> Ca2+(aq) + CO32-(aq)
Ksp CaCO3 = [Ca2+][CO32-]
Konstanta hasil kali kelarutan akan berubah bila suhu diubah, dan tetap bila suhu tidak berubah.
Pengaruh Ion Senama

Kelarutan zat dipengaruhi oleh ion penyusun pelarut.
Kelarutan zat pada pelarut yang mengandung ion senama dengan zat akan memperkecil kelarutan karena menggeser kesetimbangan.
Contoh:
Kelarutan AgCl pada NaCl dipengaruhi ion Cl-,
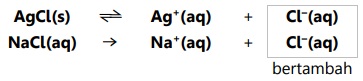
Kesetimbangan bergeser ke kiri karena Cl- bertambah, sehingga lebih banyak AgCl yang mengendap dalam NaCl dibanding dalam air.
Nilai kelarutan ion senama dari zat yang dilarutkan diabaikan karena nilainya kecil, dan yang digunakan adalah konsentrasi ion senama dari pelarut.
Contoh:
Jika Ksp PbCl2 = 1,7 x 10-5 , berapa kelarutan PbCl2 dalam HCl 0,1 M?

Materi Kimia SMA - 11 MIA Lainnya
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved