Materi Kimia - Hukum Termokimia Kelas 11 MIA - Belajar Pintar
BelajarPintarV3
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab kedua.
Yuk, mulai belajar bersama!
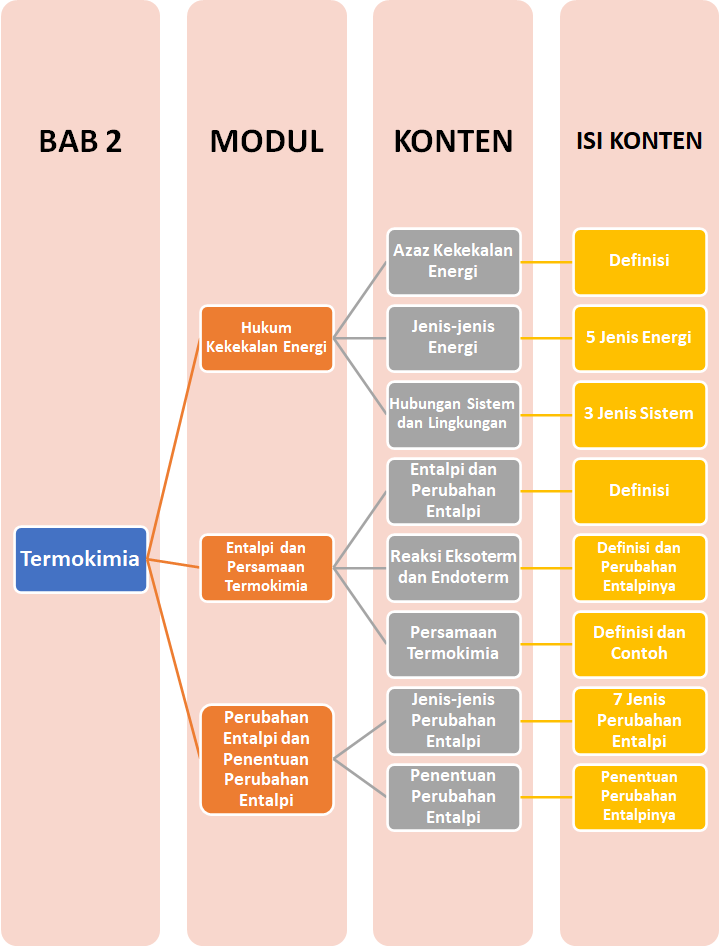
Hukum Kekekalan Energi

Hukum Kekekalan Energi menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi dapat diubah dari satu bentuk ke bentuk lain. Hukum kekekalan energi disebut juga hukum pertama termodinamika. Energi juga dapat mengalami perpindahan dari sistem ke lingkungan atau sebaliknya. Sistem merupakan segala hal yang diteliti perubahan energinya. Sedangkan lingkungan merupakan segala sesuatu di luar sistem.
Contoh sistem dan lingkungan dapat diamati pada air teh panas dalam gelas. Air teh panas merupakan sistem, sementara gelas sebagai wadahnya termasuk lingkungan.
Energi terdiri atas berbagai jenis, di antaranya energi kinetik, energi potensial, energi kimia, energi radiasi, dan energi panas. Energi panas (kalor) mengalami perpindahan melalui dua cara :
- Kalor berpindah dari sistem ke lingkungan (disebut reaksi eksoterm)
- Kalor berpindah dari lingkungan ke sistem (disebut reaksi endoterm).
Untuk penjelasan mengenai berbagai jenis energi, sobat pintar dapat mempelajarinya di materi berikutnya
Entalpi dan Perubahan Entalpi

Setiap zat kimia memiliki energi. Energi ini tersimpan dalam bentuk energi potensial dan dikenal sebagai energi kimia. Besarnya energi yang dimiliki suatu zat disebut dengan entalpi dan dinotasikan dengan H (Heat Content). Harga entalpi suatu zat/sistem tidak dapat ditentukan, yang dapat ditentukan adalah perubahan entalpi yang menyertai suatu proses (proses kimia atau fisika).
Perubahan entalpi adalah selisih antara entalpi akhir (produk) dengan entalpi awal (pereaksi).
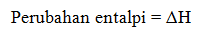
Untuk reaksi :
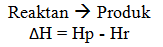
Dengan keterangan:
Hp = entalpi produk
Hr = entalpi reaktan
Apabila reaksi berlangsung pada tekanan tetap dan jenis kerja yang menyertainya hanya kerja ekspansi, maka perubahan entalpi sama dengan jumlah kalor yang diserap atau dibebaskan.
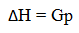
(Gp = kalor reaksi pada tekanan tetap). Jadi, perubahan entalpi adalah besarnya energi (kalor/panas) yang dibebaskan atau diperlukan dari suatu reaksi kimia.
Jenis-jenis Perubahan Entalpi

Jenis-jenis Perubahan Entalpi
- Perubahan Entalpi Pembentukan Standar
Perubahan entalpi yang terjadi pada pembentukan 1 mol senyawa dari unsur-unsurnya pada suhu dan tekanan standar (25oC, 1 atm).
Contoh:
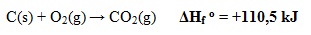
- Perubahan Entalpi Penguraian Standar
Perubahan entalpi yang terjadi pada penguraian 1 mol senyawa menjadi unsur-unsur penyusunnya pada keadaan standar. Perubahan entalpi yang terjadi pada penguraian 1 mol senyawa menjadi unsur-unsur penyusunnya pada keadaan standar.
Contoh:
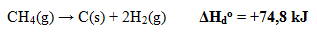
- Perubahan Entalpi Pembakaran Standar
Perubahan entalpi yang terjadi pada pembakaran 1 mol suatu zat secara sempurna pada keadaan standar.
Contoh:
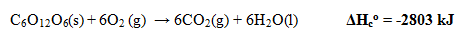
- Perubahan Entalpi Netralisasi Standar
Perubahan entalpi yang terjadi pada penetralan 1 mol asam oleh basa atau 1 mol basa oleh asam pada keadaan standar.
Contoh:
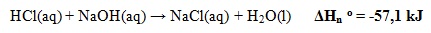
- Perubahan Entalpi Penguapan Standar
Perubahan entalpi yang terjadi pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada keadaan standar.
Contoh:

- Perubahan Entalpi Peleburan Standar
Perubahan entalpi yang terjadi pada pencairan / peleburan 1 mol zat dalam fase padat menjadi zat dalam fase cair pada keadaan standar.
Contoh:
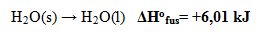
- Perubahan Entalpi Pelarutan Standar
Perubahan entalpi yang terjadi ketika 1 mol zat melarut dalam suatu pelarut (umumnya air) pada keadaan standar.
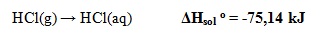
- Perubahan Entalpi Pengatoman Standar
Perubahan entalpi yang terjadi ketika 1 mol suatu senyawa menjadi atom-atomnya dalam bentuk gas pada keadaan standar.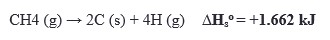
Materi Kimia SMA - 11 MIA Lainnya
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved