Materi Kimia - Larutan Asam dan Basa Kelas 11 MIA - Belajar Pintar
BelajarPintarV3
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab kelima.
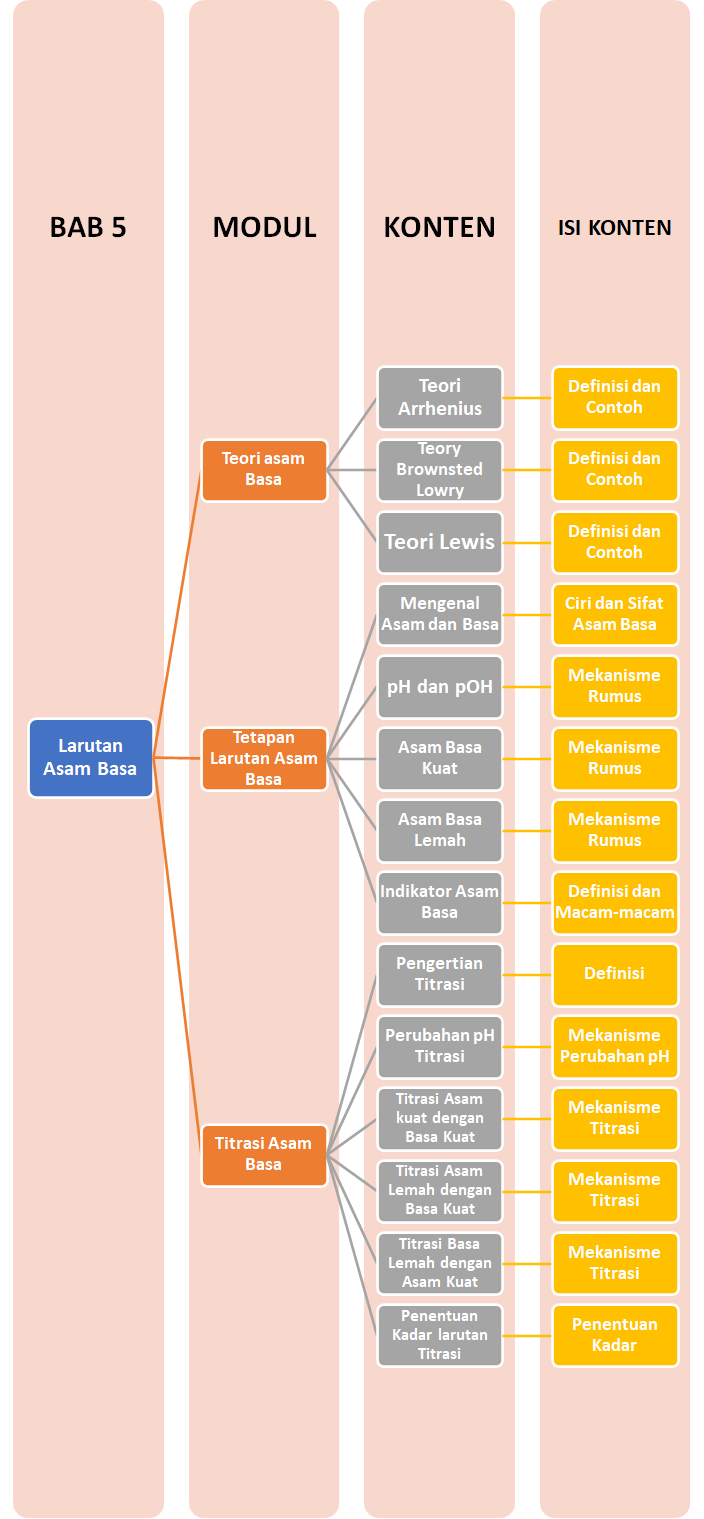
Yuk, mulai belajar bersama!
Teori Arrhenius (oleh Svante August Arrhenius)

Sobat Pintar, menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika dilarutkan dalam air dapat membebaskan H+ (ion hidrogen) atau dengan kata lain sifat pembawa asamnya adalah ion H+. Basa didefinisikan sebagai senyawa yang jika dilarutkan dalam air dapat membebaskan OH- (ion hidroksida) Sifat pembawa basanya adalah ion OH-.
Reaksi ionisasi asam dalam air
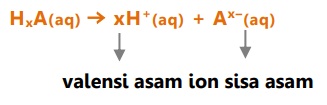
Contoh:
Asam klorida = HCl --> H+ + Cl-
Asam sulfida = H2S --> 2H+ + S2-
Reaksi ionisasi basa dalam air
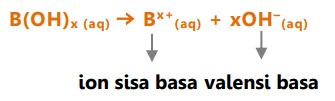
Contoh:
Natrium hidroksida = NaOH --> Na+ + OH-
Magnesium hidroksida = Mg(OH)2 --> Mg2+ + 2OH-
Mengenal Asam dan Basa

Asam
Coba perhatikan gambar berikut!

Gambar di atas merupakan salah satu contoh asam di mana jeruk mengandung vitamin C dengan nama senyawanya adalah asam askorbat.
Ciri-ciri asam
Secara umum asam memiliki ciri-ciri sebagai berikut:
- Rasa masam jika dicicipi (jangan menguji asam kuat dengan mencicipinya)
- Derajat keasaman lebih kecil dari 7 (pH < 7)
- Terasa menyengat jika disentuh, terutama asam kuat
- Reaksi dengan logam bersifat korosif (menyebabkan karat, dapat pula merusak jaringan kulit/iritasi dan melubangi benda yang terbuat dari kayu atau kertas jika konsentrasinya tinggi)
- Merupakan larutan elektrolit sehingga dapat menghantarkan arus listrik.
Sifat asam:
- Mempunyai rasa asam
- Mengubah lakmus biru menjadi merah
- Bersifat korosif, dapat melarutkan berbagai logam
- Dapat melarutkan batu kapur menghasilkan gas karbon dioksida.
Basa
Perhatikan gambar berikut!

Gambar di atas merupakan salah satu contoh basa di mana sabun dibuat dengan menggunakan NaOH atau natrium hidroksida sebagai penyusun sabun.
Ciri-ciri basa
Secara umum basa memiliki ciri-ciri sebagai berikut:
- Rasa pahit jika dicicipi
- Dalam keadaan murni umumnya berupa kristal padat
- Tingkat keasaman lebih besar dari 7 (pH > 7)
- Terasa licin di kulit (jangan menguji basa kuat dengan menyentuhnya)
- Memiliki sifat kaustik, yaitu merusak kulit jika kadar basanya tinggi
- Dapat mengemulsi minyak
- Merupakan elektrolit, larutannya dapat menghantarkan arus listrik
Sifat basa:
- Rasanya pahit
- Mengubah lakmus merah menjadi biru
- Bereaksi dengan lemak membentuk sabun.
- Menetralkan sifat asam
- Bersifat korosif, khususnya basa kuat.
Pengertian Titrasi Asam Basa

Titrasi, yaitu merupakan sebuah metode yang dapat digunakan untuk menentukan suatu konsentrasi sebuah larutan. Caranya adalah dengan menetesi (menambahi sedikit demi sedikit) larutan yang akan dicari konsentrasinya (analit) dengan sebuah larutan hasil standarisasi yang sudah dapat diketahui konsentrasi dan volumenya (titrant) sampai ia tepat habis bereaksi (titik ekuivalen) yang dibantu oleh indikator asam-basa. Titrasi (penetesan) dihentikan tepat pada saat indikator asam-basa menunjukkan perubahan warna (titik akhir titrasi).
Titrasi Asam Basa, yaitu merupakan penentuan kadar suatu larutan basa dengan larutan asam yang ingin diketahui kadarnya atau sebaliknya, kadar suatu larutan asam dengan larutan basa yang ingin diketahui, dengan didasarkan pada reaksi netralisasi.
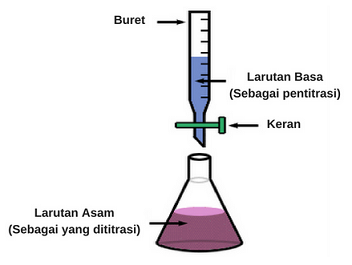
Menetapkan kadar suatu larutan dengan mereaksikan sejumlah larutan tersebut yang volumenya terukur dapat kita ukur dengan suatu larutan lain yang telah diketahui kadarnya (larutan standar) dan juga secara bertahap.
Materi Kimia SMA - 11 MIA Lainnya
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved