Materi Kimia - Larutan Penyangga Kelas 11 MIA - Belajar Pintar
BelajarPintarV3
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab ketujuh.
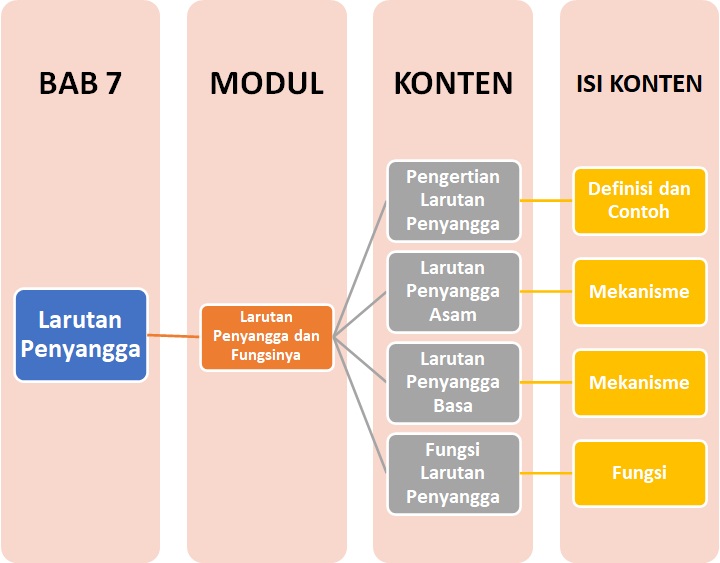
Yuk, mulai belajar bersama!
Pengertian Larutan Penyangga

Larutan penyangga adalah suatu sistem larutan yang dapat mempertahankan nilai pH larutan agar tidak terjadi perubahan pH yang berarti oleh karena penambahan asam atau basa maupun pengenceran. Larutan ini disebut juga dengan larutan buffer atau dapar.
Larutan penyangga adalah:
Campuran asam lemah dengan garamnya atau basa konjugasinya.
Contoh:
CH3COOH dengan CH3COONa
CH3COOH dengan CH3COO-
Campuran basa lemah dengan garamnya atau asam konjugasinya.
Contoh:
NH4OH dengan NH4Cl
NH4OH dengan NH4+
Sifat larutan penyangga:
- pH larutan tidak berubah jika diencerkan.
- pH larutan tidak berubah jika ditambahkan ke dalamnya sedikit asam atau basa.
Materi Kimia SMA - 11 MIA Lainnya
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved